
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、概念剖析是基础
电解质 :在水溶液里或熔融状态下能导电的化合物叫做电解质。
非电解质 :在水溶液里和熔融状态下都不能导电的化合物叫做非电解质。
1、从概念可以看出,电解质和非电解质的区别在于“或”与“和”,前者则表示,只需满足其中一个条件即可成立,即在水溶液中能导电的化合物可以叫做电解质,在熔融状态下能导电的化合物也可以叫做电解质;而后者,则需两个条件同时满足,即在水溶液里和熔融状态下同时都不能导电的化合物才能叫做非电解质,也就是说,不能表述为:在水溶液里不能导电的化合物叫做非电解质,同理,也不能表述为,在熔融状态下不能导电的化合物叫做非电解质。
2、还需要注意的是概念中的 “化合物 ”,无论是电解质还是非电解质,其前提都必须是化合物,脱离化合物这一范畴,讨论电解质与非电解质是没有意义的。
比如 Cu、C、O2等单质,空气,海水,溶液等混合物,这些既不是电解质,也不属于非电解质。
3、对于在水溶液中,大部分学生还是能理解的,但对于熔融状态可能很多同学有疑问。熔融状态其实是:在常温下,固体物质(一定是纯净的物质而不是混合物 )在一定温度下达到熔点后变成液态物质,有液体的某些物理性质,叫该物质的熔融状态。
4、化合物不是电解质就是非电解质。在接下来再分类中得以体现。
二、再分类(根据概念系统化)
引导性的再分类,可以在学生脑中形成物质的分类图,利用分类图可以比较有系统地记住相关知识,并且容易判断哪些是电解质,哪些是非电解质。比如,根据以下提供的知识点:
1、电解质 :分为强电解质、弱电解质。
强电解质包括强酸 (如 HCl、HNO3、H2SO4、HClO4等)、强碱 (如 KOH、NaOH、Ca(OH)2等)、大多数盐等。
弱电解质包括弱酸、弱碱、个别盐和水.
2、非电解质 :除有机酸以外的有机物,非金属氧化物,非金属氢化物。如:NH3。
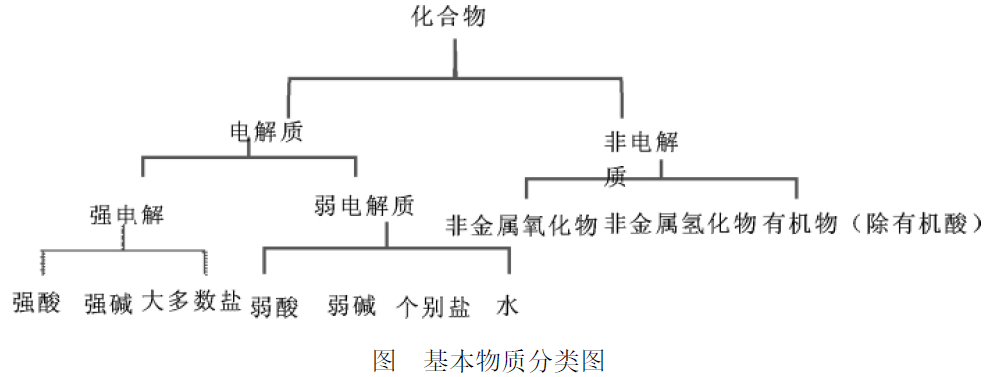
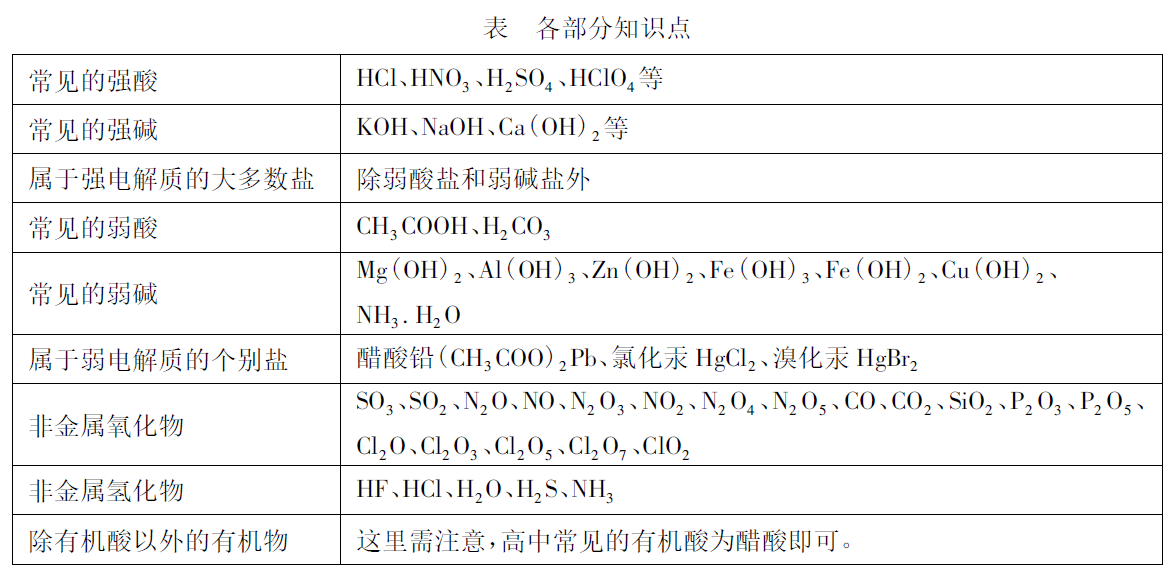
这是学习电解质与非电解质学生该有的基本物质分类图,在此处,还应该在掌握基本框架的同时,细化各部分知识点。比如:
三、实地演练 (转化为自己的武器)
单凭概念的讲解还是不够的,如果没有实战演练,不过也只是纸上谈兵。以下例题 :
例:下列物质中,哪些是电解质哪些是非电解质?
1盐酸 ;2碳酸钠溶液 ;3氨气 ;4二氧化碳 ;5氧化钠;6氯化银 ;7纯水。
根据以上知识点的归纳,可以得出以下答案:电解质 :567;非电解质 :34。
但是不是真正理解了呢,不妨看一下解析,1盐酸不是电解质,因为盐酸是氯化氢的水溶液,是混合物,不是化合物,所以不是电解质,但盐酸中的氯化氢是电解质 ;2碳酸钠溶液不是电解质。同理,因为碳酸钠溶液是混合物,不是化合物,但溶液中的碳酸钠是电解质;3氨气是非电解质,氨气本身不导电,但氨气溶于水后,生成一水合氨,能电离出氢氧根离子和铵根离子,能导电。4二氧化碳不是电解质,虽然二氧化碳的水溶液能导电,但是导电的原因是因为二氧化碳和水反应生成了碳酸,这时的电解质是碳酸,而不是二氧化碳,所以,必须是本身能导电。5氧化钠在熔融状态下能导电。6氯化银是电解质,虽然氯化银难溶于水,但其水溶液中有少量自由离子,具有弱导电性。且熔融状态下氯化银也可以导电;7纯水可视为一级弱的电解质。
四、解题误区
解题后就会发现,除了以上归纳的,还有很多细节需要注意。
1、电解质和沉淀没有必然联系。沉淀在水中溶解的量很少,但是有一些在水溶液中溶解的部分完全电离,那么也是属于电解质。比如CaCO3、BaSO4等。
2、电解质的强弱和溶液浓度的大小没有必然关系。浓度大的不一定是强电解质。比如 Cu(OH)2,是强电解质,但溶液浓度不大;而 CH3 COOH可以和水以任意比互溶,但是 CH3 COOH是弱电解质。
3、溶液导电能力和电解质的强弱没有必然关系。
这一点还是要回到电解质导电的本质,导电能力是自由离子的个数和离子所带电荷数决定的。在相同的条件下,浓度相同的电解质,导电能力强,不能说明一定是强电解质,但是,如果是导电能力弱的,一定是属于弱电解质。
4、对于有些物质来说,虽然水溶液中有自由移动离子,但本身也不是电解质。常见的比如,CO2,溶于水后,生成碳酸溶液,能导电,但导电的不是 CO2本身,并且 CO2在熔融状态下,不能电离出离子,二氧化碳本身不是电解质。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。离子方程式书写的核心难点之一,在于 “特殊物质的拆分判断”—— 部分物质因结构、溶...
电离方程式是表征物质在水溶液或熔融态电离过程的化学用语,常规强电解质(如 NaCl、HS...
离子方程式书写四大原则之一关键是拆分问题 1、 溶解性规律 常规 K + 、 Na + 、 NH 4...
1.警惕“颜色陷阱”: ①若限定溶液无色,则Cu 2+ 、Fe 3+ 、Fe 2+ 、Cr 2 O 7 2 ...
用化学式 和 离子符号等来表示物质离解成自由移动离子过程的式子叫做电离方程式。 书...
一句话总结:熔融态就是 固体加热熔化后的状态 。 在某个层面上,它和液态是一回事 (...