
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、乙醇的结构
首先,和水(H-OH)相比,乙醇(CH₃CH₂-OH)分子中的-CH2CH3是推电子基团,使得CH3CH2OH中-OH的极性变弱,是弱极性分子。
所以水(H-OH)中加入乙醇(CH₃CH₂-OH),极性减弱。
当乙醇与非极性溶剂(如环己烷)混合时,会提高混合溶剂的极性。
或者说,乙醇(CH₃CH₂-OH),一端是亲水的极性羟基(-OH),另一端是疏水的非极性乙基(-CH₂CH₃)。
这使得它既能“亲水”又能“亲油”,这种具有极性溶剂和非极性溶剂的双重性质,我们简称它为双亲性。
所以水(H-OH)中加入乙醇(CH₃CH₂-OH),亲油性增强。
也就是说,乙醇对不同溶质的溶解度有不同的影响。答案是取决于体系,乙醇既可以增大溶质溶解度,也可以减小溶质溶解度。关键要看溶质和原来的溶剂是什么。
二、水溶液加入乙醇后,溶质溶解度降低,更容易析出晶体。
溶质是强极性物质,比如离子型化合物等。
根据相似相溶原理可知,加入乙醇后,溶质溶解度降低,更容易析出
1.教材中的例子《选择性必修2:物质结构与性质》:一水合硫酸四氨合铜的生成

三支试管里都装有硫酸铜溶液。此时溶液中有[Cu(H2O)4]2+,呈天蓝色。

第一支试管中,滴入少量氨水,未摇匀,可以清楚地看到上层是深蓝色,中间是天蓝色的沉淀,下层是硫酸铜溶液。
第二只试管滴入少量氨水,已摇匀,可见蓝色沉淀。
Cu2++ 2NH3•H2O=Cu(OH)2↓+2NH4+
第三只试管中滴入过量氨水,已摇匀,可见深蓝色溶液。
Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-

此时加入无水乙醇,由于[Cu(NH3)4]SO4在极性较小的乙醇中溶解度较小,因此析出[Cu(NH3)4]SO4·H2O,可以称之为醇析。
[Cu(NH3)4]2++SO42-+H2O![]() [Cu(NH3)4]SO4•H2O↓
[Cu(NH3)4]SO4•H2O↓
2.食盐水中加入乙醇,NaCl结晶析出。
NaCl是典型的离子化合物,可以理解为极性分子的天花板,理解为强极性分子,
根据相似相溶原理,NaCl溶于水。
乙醇和水相比,可以理解为非极性分子,NaCl不溶于乙醇。
最终NaCl结晶析出。
拓展:阴阳离子在水中会被一层紧密的水分子包围(水化层),这是它们能溶解的原因。乙醇会和水形成分子间氢键,会破坏这种水化层,使离子失去稳定性。
3.已知蔗糖在酒精中溶解度不大,蔗糖溶液加入乙醇,有晶体析出。
一方面,根据已知可分析出,蔗糖易溶于水,不易溶于酒精。加入酒精,溶解度减小,所以有晶体析出。
另一方面,蔗糖分子含多个羟基(-OH),与水分子形成较多的分子间氢键,溶于水。
乙醇含有乙基,和蔗糖分子形成的分子间氢键少,溶解度小。
加入乙醇,乙醇既不能像水那样和蔗糖形成较多的分子间氢键,
又和水形成分子间氢键,争夺水分子和蔗糖形成分子间氢键。
导致蔗糖溶解度下降并析出。

4.在制药工艺中,向某些抗生素的水溶液中加入乙醇,可以使其结晶出来,便于纯化和分离。
5.酿造酒类时,酒精浓度过高(如烈酒)可能会使一些盐分或杂质析出。
6.生物实验,DNA的粗提取,需要加入酒精
在研磨好的洋葱液中加入大量的、冷却的无水乙醇,溶液中会出现白色的丝状物,即被沉淀出来的DNA。
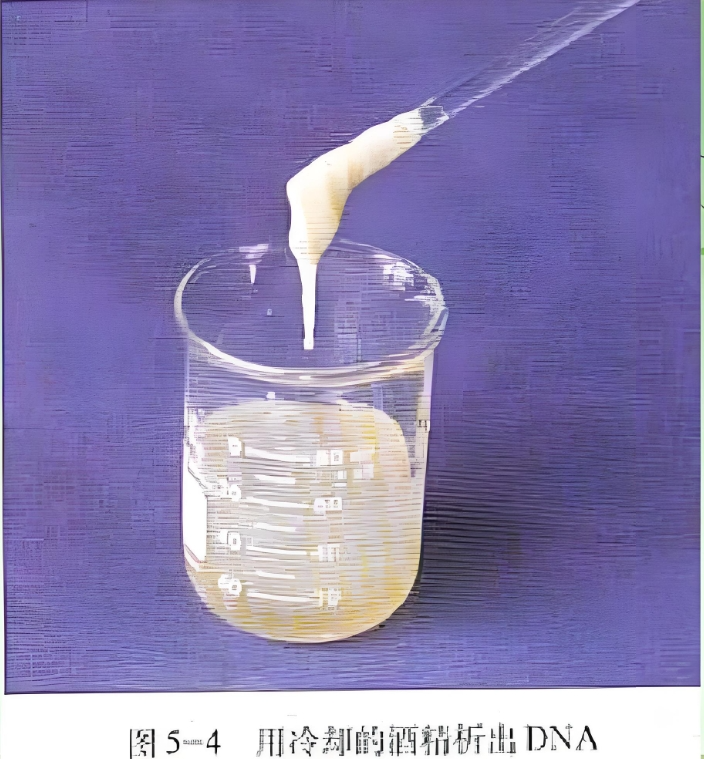
DNA是一种亲水性分子,结构中包含磷酸骨架与碱基。带有大量负电荷,属于典型的极性大分子,使得DNA分子能够轻松溶解于水中,但难溶于酒精。
乙醇的加入,和水分子形成分子间氢键,使得DNA分子周围的水分子减少。
同时DNA分子属于胶体范畴,乙醇分子本身不带电荷,不会与DNA分子发生静电排斥,从而有利于DNA分子的聚集。
在沉淀DNA的过程中,通常会加入一定量的盐(如醋酸钠、醋酸铵等)。这些盐中的阳离子(如Na+、NH₄⁺)可以与DNA分子的负电荷结合,进一步降低DNA分子间的静电排斥力,促进DNA的沉淀。这称之为盐析。
异丙醇的极性小于乙醇,因此它与水分子之间的相互作用更弱。当异丙醇加入DNA溶液后,DNA分子更容易从水相转移到异丙醇相中。
异丙醇的沉淀效果优于乙醇,沉淀的时间更短,所需的体积更少,但是异丙醇沉淀出来的杂质也会增多,因为异丙醇在降低DNA溶解度的同时也降低了盐类的溶解度。所以在实验过程中一般在沉淀DNA之后再使用75%的乙醇洗涤DNA,从而达到纯化DNA的效果。
三、水溶液加入乙醇后,溶质溶解度增大
1.肥皂的制备过程,加入乙醇
在油脂的皂化反应中,加入乙醇,既能溶解NaOH,又能溶解油脂,增大油脂的溶解度,让它们在均相(同一溶剂的溶液)中充分接触,加快反应速率,提高反应限度。
2.碘酒配制加入酒精
碘单质在水中的溶解度很小,溶液呈浅黄色。
碘酒中有碘、酒精、水等物质。碘(I₂)是非极性分子,在水中溶解度极低(约0.02g/L);碘水中碘的浓度不大,但碘易溶于乙醇,加入酒精,增大碘在混合溶剂的溶解度,形成棕红色碘酒。
3.苯酚不易溶于水,水溶液加入酒精,苯酚溶解。
苯酚兼具亲水基(羟基)和憎水基(苯基),在水中溶解度不大。
但酒精和苯酚一样,既含有亲水基,也含有憎水基,
二者亲水基喜欢亲水基,憎水基喜欢憎水基,溶解度增大。
苯酚乳浊液加入酒精,苯酚溶解。
4.硫粉和碱溶液反应,加入乙醇
硫不溶于水,微溶于酒精,易溶于二硫化碳。
加入乙醇,硫的溶解度增大,使硫粉易于分散到溶液中。
不加入CS2,因为CS2不溶于水,无法增大硫在氢氧化钠溶液中的溶解度。
5.药物使用乙醇作为助溶剂
对于一些弱极性或两亲性的药物分子,如中药药剂,或者精油,它们在水中的溶解度不高,单独使用乙醇溶解成本高或刺激性大。此时,将少量乙醇加入水中,可以显著提高这些物质在水中的溶解度。
原因是乙醇的非极性部分与药物的非极性部分相互作用,而它的极性部分与水分子相互作用,从而将药物拉入水中。乙醇在这里是助溶剂。一些外用酊剂或口服液利用了乙醇的助溶作用。
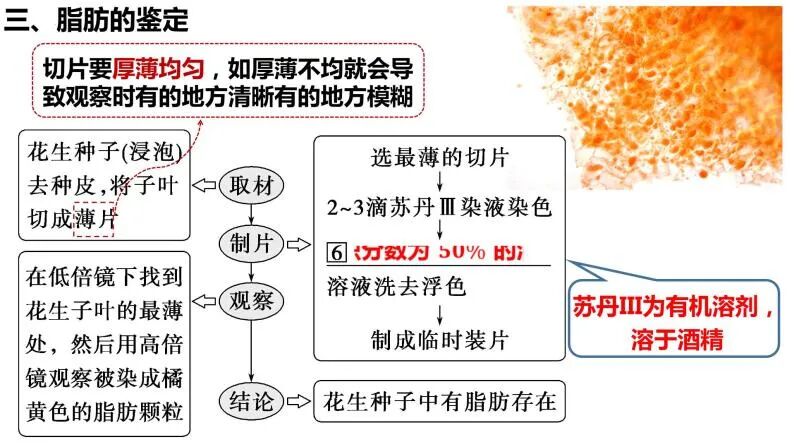
6.生物实验,酒精在“检测生物组织中的脂肪”中的应用
实验过程中加入酒精,洗去浮色(用于染色的苏丹Ⅲ或苏丹Ⅳ染液)。
若不除去浮色,就会导致染色过深从而影响观察效果。
根据相似相溶的原理,酒精能够洗去浮色。
四、洗涤沉淀时,有时不用水,而用水的酒精溶液,为啥?
洗涤沉淀时选择水的酒精溶液(乙醇-水混合溶剂),而不选择蒸馏水,核心目的是在有效去除沉淀表面杂质的同时,最大限度减少目标沉淀的溶解损失,并可能提升洗涤效率或便于后续处理。
由上可知,并非所有沉淀洗涤都适合用乙醇-水混合液,其适用条件需满足:
目标沉淀,加入乙醇后沉淀溶解度降低,避免损失;杂质要么易溶于乙醇,要么易溶于水。
1.洗涤的首要原则是“不损失目标沉淀”。
当目标沉淀为强极性物质(如离子型盐、强极性有机物)时,其在纯水中有一定溶解度(并非完全不溶),直接用水洗涤会导致部分沉淀溶解而损失;加入乙醇后,混合溶剂的极性降低,可显著降低强极性沉淀的溶解度,从而减少损失。
(1)洗涤氯化钠(NaCl)沉淀:
NaCl易溶于水,难溶于乙醇。
若用纯水洗涤NaCl沉淀,每次洗涤都会有少量NaCl溶解;
改用“70%乙醇- 30%水”混合液,由于溶剂极性下降,NaCl的溶解度大幅降低,溶解损失可忽略不计。
(2)洗涤硫酸钡(BaSO₄)沉淀:
硫酸钡(BaSO₄)不溶于水,但乙醇中的溶解度比水中更低。
重量分析法中测定钡含量时,需用“稀乙醇溶液”洗涤BaSO₄沉淀,溶解度更小,避免因多次水洗导致的微小溶解累积误差。
2.杂质更容易除去
若杂质为弱极性或非极性有机物,如反应中残留的油脂、有机中间体、苯、环己烷,这类杂质在纯水中溶解度低,难以被水洗掉;但乙醇可溶解弱极性杂质,因此“水的酒精溶液”既能减少沉淀损失,又能通过乙醇将杂质溶解并带走。
3.加速沉淀的干燥过程
乙醇沸点低,易挥发。
用“水的酒精溶液”洗涤后,乙醇会快速挥发,同时带动水分蒸发,大幅缩短沉淀的干燥时间。
干燥时,室温下即可快速挥发,或短时间低温干燥即可。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
一、干燥 干燥是除去固体液体或气体中含有的水分或有机溶剂的...
一、乙醇的结构 首先,和水(H-OH)相比,乙醇(CHCH-OH)分子中的...
...
中学化学 实验 中,有许多处都用到饱和溶液,现举例如下。 一...
在通常状况下,1体积水能溶解氯气约2体积(折算为标准状况)...
高中化学教材实验中多次出现的饱和食盐水 一、氯气的净化除杂...