
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
高考实验综合题中,经常涉及对所得晶体或固体残渣进行洗涤,洗涤大有讲究,要考虑几个方面,如:为什么要洗涤?用什么洗涤?怎样洗涤?怎样证明已经洗涤干净?等等。
一、洗涤目的
关于晶体或残渣为什么要洗涤,即洗涤的目的,常见有:
①若滤渣是所需的物质,则洗涤的目的是:
除去晶体表面的可溶性杂质,得到更纯净的晶体。
②若滤液是所需的物质,则洗涤的目的是:
洗涤残渣,把附着在残渣上的有用物质,如目标产物尽可能洗出来。
③防止污染环境:如果滤渣表面有一些对环境有害的物质,如重金属离子或CN-,
为了防止污染环境,往往对残渣进行洗涤。
例1、用FeSO4溶液与稍过量的NH4HCO3溶液混合,得到含FeCO3的浊液;将浊液过滤;.用90℃热水洗涤沉淀,干燥后得到FeCO3固体;
已知:NH4HCO3在热水中分解。
问题:IV中为什么要用热水洗涤?
解析:FeSO4溶液与稍过量的NH4HCO3溶液混合,在得到FeCO3的浊液里含有杂质离子SO42-和过量的NH4HCO3,由于NH4HCO3在热水中会分解,这样就除去了NH4HCO3,另外也可除去SO42-。
答案为:可以除去可溶性的杂质SO42-和NH4HCO3。
例2、(2010江苏第16题):钡盐行业生产中排出大量的钡泥[主要含有BaCO3、BaSiO3、BaSO3、Ba(FeO2)2]等。某主要生产BaCl2、、BaCO3、BaSO4的化工厂利用钡泥制取Ba(NO3)2,其部分工艺流程如下:
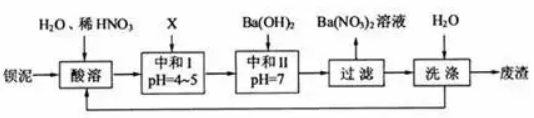
问题:上述流程中洗涤的目的是 。
解析:钡泥加入稀硝酸后BaCO3、BaSiO3变为Ba2+、CO2气体、H4SiO4(或H2SiO3)沉淀,BaSO3转化为BaSO4,Ba(FeO2)2转化为Ba2+和Fe3+,加入BaCO3等,可调节溶液的pH=4~5,把Fe3+转化为Fe(OH)3沉淀,接着加入Ba(OH)2可把少量的HNO3转化为Ba(NO3)2,这里洗涤的目的是把滤渣表面的硝酸钡除去,防止污染环境,这是标准答案。把洗涤液又加入到初始的溶液中,相当于残液又被利用,提高了原料钡泥的利用率。
最佳答案为:减少废渣中可溶性钡盐对环境的污染;提高原料钡泥的利用率。
二、洗涤的方法
洗涤的方法 | 注意点 | 三个得分点 |
让过滤后的晶体继续留在过滤器中,加入洗涤剂浸没晶体,让洗涤液自然流下,重复2~3次即可 | 在洗涤过程中不能搅拌。因为滤纸已经润湿,如果搅拌很容易搅破滤纸,造成晶体损失 | 注洗涤液→加洗涤液→重复操作 (1)注洗涤液:沿玻璃棒向漏斗中注入洗涤液 (2)加洗涤液:洗涤液完全浸没晶体 (3)重复操作:重复操作2~3次 |
三、洗干净的判断方法
如果可溶性的杂质的水溶液有颜色,可以直接通过观看最后一次洗涤液是否有颜色,如果显无色,说明已洗涤干净,反之没有洗涤干净;
对于含Na+、K+的可溶性杂质可以通过焰色反应来鉴别,从而判断有无洗涤干净;对于用物理方法无法判断的,可以通过化学方法来判断。
方法是:取最后一次洗涤液来做实验。
四个得分点 | 答题模板 | 常见离子检验的试剂 |
取样→滴加试剂→描述现象→得出结论 (1)取样:取少量最后一次洗涤滤液 (2)滴加试剂:滴加合理试剂 (3)描述现象:根据所发生的反应描述现象 (4)得出结论:沉淀洗涤是否干净 | 取样:取少量最后一次洗涤滤液于一洁净的试管中 试剂:加入××试剂(有必要时加热) 现象:不产生××沉淀、溶液不变××色、不产生××气体 结论:说明沉淀已经洗涤干净 | SO42-:稀盐酸和氯化钡溶液 Cl-:稀硝酸和硝酸银溶液 Fe3+:硫氰化钾溶液 |
例1、富马酸亚铁(分子式C4H2O4Fe,是一种可限量使用的铁强化剂
问题:操作Y包括蒸发浓缩、冷却结晶、过滤、洗涤、干燥等。判断该操作中“洗涤”富马酸亚铁产品已洗净的实验方法是______。
解析:富马酸亚铁表面的可溶性杂质离子有Na+、SO42-等,可以从检验洗涤液中是否含Na+或SO42-来设计实验。
参考答案为:取最后一次洗涤液,先加入稀盐酸,再加入氯化钡溶液,无白色沉淀生成,说明已洗涤干净。
例如(2009北京卷改编)以富含硫酸亚铁的工业废液为原料生产氧化铁的工艺如下(部分操作和条件略)IV中,洗涤后,通过检验SO42-来判断沉淀是否洗涤干净.
检验SO42-的操作是:取少量洗涤后的试液放入试管中,滴加酸化的氯化钡溶液,若无白色沉淀生成,则沉淀洗涤干净。
四、洗涤所用试剂选择
洗涤试剂 | 适用范围 | 目的 | |
蒸 馏水 | 冷水 | 产物不溶于水 | 除去固体表面吸附着的××杂质;可适当降低固体因为溶解而造成的损失 |
热水 | 有特殊的物质其溶解度随着温度升高而下降 | 除去固体表面吸附着的××杂质;可适当降低固体因为温度变化而造成溶解的损失 | |
有机溶剂(酒精、丙酮等) | 固体易溶于水,难溶于有机溶剂 | 减少固体溶解;利用有机溶剂的挥发性除去固体表面的水分,产品易干燥 | |
饱和溶液 | 对纯度要求不高的产品 | 减少固体溶解,使因为溶解造成的损失降到最低 | |
酸、碱溶液 | 产物不溶于酸、碱 | 除去固体表面吸附着的可溶于酸、碱的杂质;减少固体溶解 | |
例1、苏教版教材《实验化学》“硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]的制备”。将硫酸铵饱和溶液加入到硫酸亚铁溶液中,搅拌、蒸发、浓缩、冷却,即有晶体析出。抽滤,并用酒精洗去晶体表面附着的水分。
1、酒精洗涤——减少晶体溶解;利用乙醇的挥发性除去晶体表面的水分
解析:由于摩尔盐属于无机盐,在水中的溶解度大于在乙醇中,用乙醇洗涤可以降低摩尔盐因为溶解而造成损失;其次,由于水易溶于乙醇,用乙醇可以除去水,并把可晶体表面的杂质“冲走”;另外,酒精易挥发,很容易使晶体保持干燥。
例2、工业上常用如下方法制备高铁酸钾:以铁丝网为阳极电解氢氧化钠溶液,然后在阳极液中加50%的氢氧化钾溶液,充分反应后过滤,用异丙醇洗涤、干燥,即可制得。
用异丙醇代替水洗涤产品的好处是:减少洗涤时产品的损失且产品易干燥
例3、“阿司匹林的制备”:将水杨酸、乙酸酐、浓硫酸的混合物水浴共热5—10分钟后,冷却即得乙酰水杨酸晶体,减压过滤,用滤液淋洗锥形瓶,直到所有晶体被收集到布氏漏斗中。
例4、(2011浙江高考)二苯基乙二酮常用作医药中间体及紫外线固化剂,可由二苯基羟乙酮氧化制得,反应的化学方程式及装置图如下:
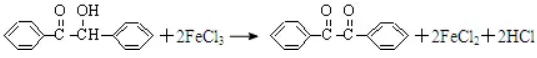
在反应装置中,加入原料及溶剂,搅拌下加热回流。反应结束后加热煮沸,冷却后即有二苯基乙二酮粗产品析出,用70%乙醇水溶液重结晶提纯。
重结晶过程:加热溶解→活性炭脱色→趁热过滤→冷却结晶→抽滤→洗涤→干燥
问题:烧杯中的二苯基乙二酮晶体转入布氏漏斗时,杯壁上往往还粘有少量晶体,需选用液体将杯壁上的晶体冲洗下来后转入布氏漏斗,下列液体最合适的是_D_。
A.无水乙醇 B.饱和NaCl溶液 C.70%乙醇水溶液 D.滤液
2、滤液洗涤——减少晶体溶解 ,(常用于晶体的转移)
例5(2005江苏高考试题):硫酸亚铁(FeSO4·7H2O)是一种重要的食品和饲料添加剂。实验室通过下列实验由废铁屑制备FeSO4·7H2O晶体:
问题:实验步骤④中用少量冰水洗涤晶体,其目的是_____________;_______________。
解析:冰水作为洗涤剂,应该从两方面来说明。首先它是水,可以将某些可溶性的杂质溶解而除去;其次,要说明作为冰水温度低有什么好处。
参考答案为:洗涤除去晶体表面附着的硫酸等杂质;用冰水洗涤可降低洗涤过程中FeSO4·7H2O的损耗。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
蒸馏的定义:通过加热气化液体物质,冷凝其蒸汽并加以收集来...
一、减压蒸馏(减压蒸发) 1.原理 在密闭的容器内,抽真空使液...
值得关注的是咱们人教版上P87这一句: 教材的书写挺严谨的,“...
“减压,能降低大部分物质的熔沸点,通过减压,可以在加热蒸...
参考答案: 1)不能;2)吸收Cl2、防止空气中的水蒸气进入体系...
一、结晶 1、结晶的概念: 是物质从无序状态(如溶液、熔融态...