
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
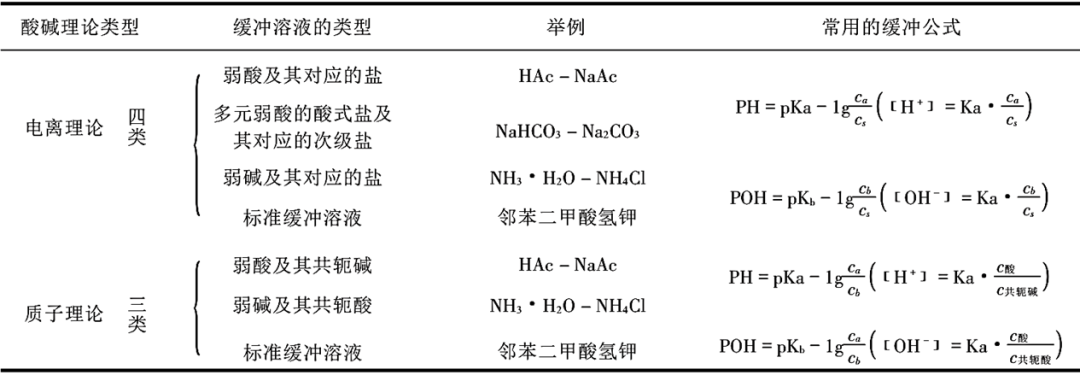
【导读】根据质子酸碱理论:酸是质子的给予体,给出质子(H⁺)的物质;碱是质子的接受体,得到质子(H⁺)的物质。
当一个酸(HA)给出一个质子(H⁺)后,剩余的部分(A⁻)就具备了接受质子的能力,成为该酸的“共轭碱”;当一个碱(B)得到一个质子(H⁺)后,形成的物质(HB⁺)就具备了提供质子的能力,成为该碱的“共轭酸”。这种通过得失一个质子而相互转化的一对酸碱:“酸-共轭碱”或“碱-共轭酸”,其对应关系就称为共轭酸碱对,其核心特征是“仅相差一个质子(H⁺)”。
酸⇌质子+共轭碱
碱+质子⇌共轭酸
一、共轭酸碱对关系的典例简析
典例1:HCl/Cl⁻
HCl=H⁺+Cl⁻
酸:HCl(强酸);共轭碱:Cl⁻(极弱的碱)。HCl几乎完全电离,酸性很强,极度倾向于失去质子,而失去质子后的共轭碱Cl⁻对质子几乎没有任何吸引力,因此碱性极弱(Cl⁻无法使水的pH改变)。
典例2:CH₃COOH/CH₃COO⁻
CH₃COOH⇌H⁺+CH₃COO⁻
酸:CH₃COOH(弱酸);共轭碱:CH₃COO⁻(弱碱)。醋酸是弱酸,部分电离,它失去质子的倾向不强,那么它的共轭碱CH₃COO⁻具有一定的结合质子的能力,因此醋酸根溶液呈弱碱性。
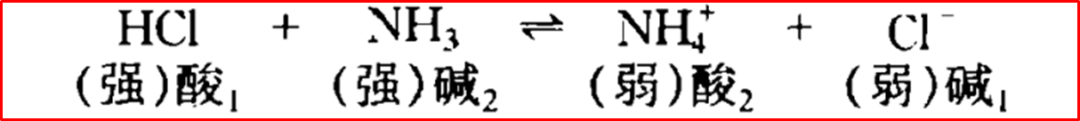
典例3:NH₄⁺/NH₃
NH₄⁺⇌H⁺+NH₃
酸:NH₄⁺(弱酸);共轭碱:NH₃(弱碱)。氨(NH₃)是典型的弱碱,它能结合质子形成NH₄⁺。反过来NH₄⁺作为一个弱酸,有微弱的能力在水中失去质子,使铵盐溶液呈弱酸性。
典例4:H₂O/OH⁻
①水作为酸:H₂O⇌H⁺+OH⁻
酸:H₂O(极弱的酸);共轭碱:OH⁻(强碱)。水自身电离的程度极小,它作为酸失去质子的能力非常弱。因此它的共轭碱OH⁻对质子有极强的吸引力,是强碱。
②水作为碱:H₂O+H⁺⇌H₃O⁺
碱:H₂O(极弱的碱);共轭酸:H₃O⁺(强酸)。
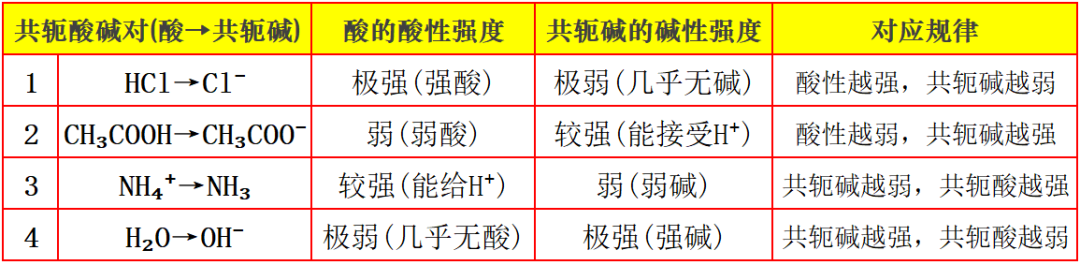
二、酸碱强度与共轭酸碱强度的关系:强弱不相逢!
核心规律:共轭酸的酸性越强,其对应的共轭碱的碱性越弱;反之,共轭碱的碱性越强,其对应的共轭酸的酸性越弱。
这一规律的本质是“质子转移能力的平衡”——酸给出质子的能力(酸性)与共轭碱接受质子的能力(碱性)是“此消彼长”的。
若酸极易给出质子(酸性强),说明其分子对质子的束缚力弱;那么它失去质子后形成的共轭碱,对质子的吸引力也弱(难以重新接受质子,即碱性弱)。
若碱极易接受质子(碱性强),说明其对质子的吸引力强;那么它得到质子后形成的共轭酸,对质子的束缚力也强(难以给出质子,即酸性弱)。
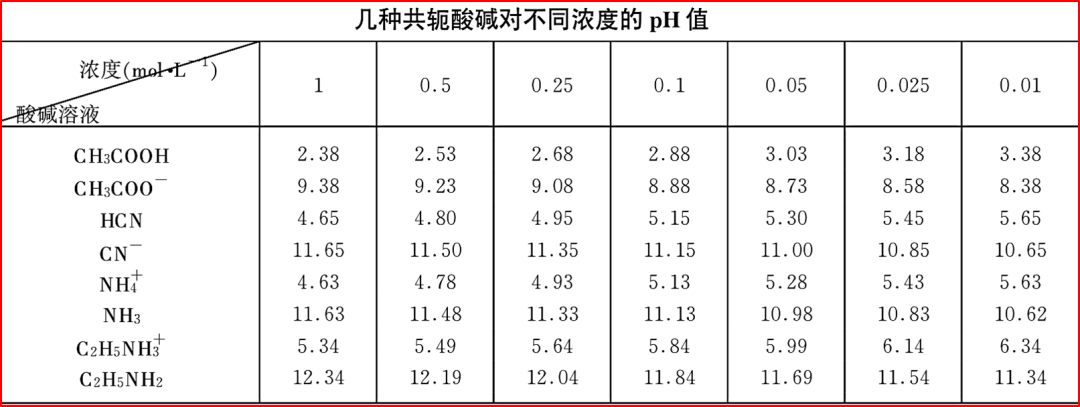
酸越强,其共轭碱越弱。
HCl(强酸)→Cl⁻(极弱碱,几乎无碱性)
CH₃COOH(弱酸)→CH₃COO⁻(弱碱)
一个酸越容易失去质子(酸性强),意味着失去质子后形成的粒子越稳定,它“想要”夺回质子的趋势就越小,所以其共轭碱的碱性就越弱。
碱越强,其共轭酸越弱。
OH⁻(强碱)→H₂O(极弱酸)
NH₃(弱碱)→NH₄⁺(弱酸)
一个碱越容易得到质子(碱性强),意味着它得到质子后形成的粒子越不稳定(能量高),它“想要”重新失去质子的趋势就越大,所以其共轭酸的酸性就越强。
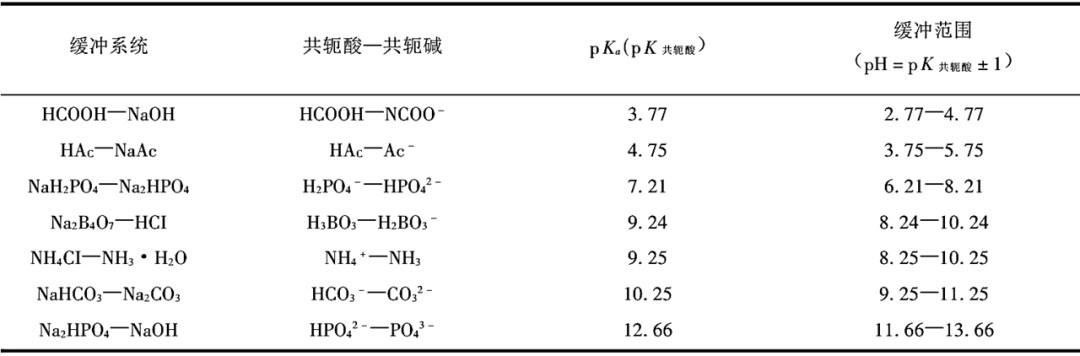
三、强弱不相逢规律可用化学平衡原理来解释
CH₃COOH⇌H⁺+CH₃COO⁻
Ka=[H⁺][CH₃COO⁻]/[CH₃COOH]
Ka值越大,酸性越强。这个平衡也隐含了其共轭碱CH₃COO⁻的强度:
CH₃COO⁻+H⁺⇌CH₃COOH
Kb=[CH₃COOH]/([H⁺][CH₃COO⁻])=1/Ka
这个反应的平衡常数Kb(共轭碱的碱度常数),Ka×Kb=Kw,这是一个定量关系!Ka值越大(酸越强),其共轭碱的Kb值必然越小(碱越弱),反之亦然。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
水溶液中NH水解显酸性,CO、HCO水解显碱性,二者会发生“相互促...
在基础化学中,我们常被告知:盐类水解通常是微弱且可逆的。...
一般来说,溶解度大的物质易转化为溶解度小的物质。那反过来...
一.定义 1.pH pH=–log[H] pH是衡量溶液整体酸碱度的指标,具体指溶...
溶解度(Solubility)与溶度积常数(Solubility Product Constant, ksp密切...
【导读】与第一电离能定义相反(并非严格互逆过程),第一电子...