
|
学习小专题 |

|
学习小专题 |
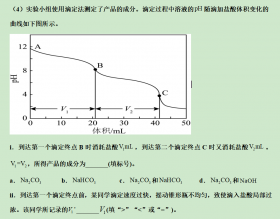 [方法与规律j] “双指示剂法”滴定解读及在高考中的考查 作者:化学自习室 来源:未知 日期:2025-06-29 16:12:27 点击:652 所属专题:双指示剂法
[方法与规律j] “双指示剂法”滴定解读及在高考中的考查 作者:化学自习室 来源:未知 日期:2025-06-29 16:12:27 点击:652 所属专题:双指示剂法
双指示剂法是一种利用两种具有不同变色范围的酸碱指示剂,在滴定过程中分别指示两个不同滴定终点的方法。它在测定混合碱(如 NaOH/NaCO 或 NaCO/NaHCO)的组成和含量方面具有“简便、快速、成本低”的优势,是分析化学中一个经典且实用的技术。 一、 核心原理 1. 指示剂的...
 [方法与规律j] 沉淀溶解平衡曲线分类解例析 作者:化学自习室 来源:未知 日期:2024-01-19 07:55:46 点击:1454 所属专题:溶解平衡图像
[方法与规律j] 沉淀溶解平衡曲线分类解例析 作者:化学自习室 来源:未知 日期:2024-01-19 07:55:46 点击:1454 所属专题:溶解平衡图像
1.两坐标为离子浓度的曲线型图像 2.坐标为对数或负对数的直线型图像 3.沉淀滴定图像 建模解决问题 第一步:明确图像中纵、横坐标的含义 纵、横坐标通常是难溶物溶解后电离出的离子浓度。 第二步:理解图像中线上点、线外点的含义 (1)以氯化银为例,在该沉淀溶解平衡图像...
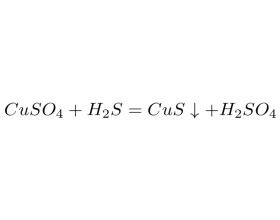 [方法与规律j] 利用化学平衡常数定量探讨弱酸制强酸计算逻辑 作者:化学自习室 来源:未知 日期:2024-01-06 15:08:35 点击:589 所属专题:强酸制弱酸
[方法与规律j] 利用化学平衡常数定量探讨弱酸制强酸计算逻辑 作者:化学自习室 来源:未知 日期:2024-01-06 15:08:35 点击:589 所属专题:强酸制弱酸
弱酸也可以制备强酸!!! 比如向 CuSO 4 溶液中加入 H 2 S 溶液生成 CuS 黑色沉淀和 H 2 SO 4 溶液的反应, 其化学方程式: 对应的离子方程式: 该反应的 平衡常数表达式 为: 这里需要用到一些式子处理的技巧,我刚刚在分子分母同乘了一个 c(S 2- ) ,分数值不变。 这...
 [方法与规律j] 氧化还原滴定法终点的判断 作者:化学自习室 来源:未知 日期:2023-12-05 08:02:28 点击:950 所属专题:氧化还原反应滴定
[方法与规律j] 氧化还原滴定法终点的判断 作者:化学自习室 来源:未知 日期:2023-12-05 08:02:28 点击:950 所属专题:氧化还原反应滴定
氧化还原滴定法: 1.特点: 氧化还原滴定法在药物分析中应用广泛,用于测定具有氧化性和还原性的物质,对不具有氧化性或还原性的物质,可进行间接测定。氧化还原反应较复杂,常伴有各种副反应,反应速度较慢,因此,氧化还原滴定法要注意选择合适条件使反应能定量、迅速、完...
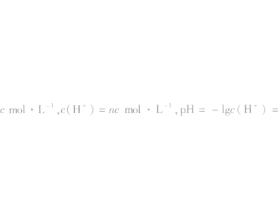 [方法与规律j] 溶液pH的计算方法 作者:化学自习室 来源:未知 日期:2023-12-18 09:32:33 点击:1425 所属专题:ph计算
[方法与规律j] 溶液pH的计算方法 作者:化学自习室 来源:未知 日期:2023-12-18 09:32:33 点击:1425 所属专题:ph计算
溶液pH计算的整体思路是:根据pH的定义pH=-lg c (H + ),溶液pH计算的核心是确定溶液中的 c (H + )相对大...
 [方法与规律j] 离子交换膜在电化学中的应用解读 作者:化学自习室 来源:未知 日期:2023-08-08 09:01:24 点击:717 所属专题:离子交换膜
[方法与规律j] 离子交换膜在电化学中的应用解读 作者:化学自习室 来源:未知 日期:2023-08-08 09:01:24 点击:717 所属专题:离子交换膜
离子交换膜在原电池和电解池中均有较广泛的应用,且常出常新。 1.离子交换膜的功能 使离子选择性定向迁移,其目的是平衡整个电解质的离子电荷守恒。 2.交换膜在电化学中的作用 (1)防止副反应的发生,避免影响所制取产品的质量;防止引发不安全因素(如在电解饱和食盐水中,...
 [方法与规律j] 电离平衡常数的解题技巧 作者:化学自习室 来源:未知 日期:2023-05-31 10:31:34 点击:1199 所属专题:电离平衡常数
[方法与规律j] 电离平衡常数的解题技巧 作者:化学自习室 来源:未知 日期:2023-05-31 10:31:34 点击:1199 所属专题:电离平衡常数
电离平衡常数是高考中一个重要的必考考点,常考查电离平衡常数的计算、弱酸的相对强弱、离子浓度离子大小的比较、离子方程式的书写等,大多结合图像进行分析。解决此类问题的关键是,掌握电离常数的概念及基本的计算方法,利用平衡移动原理,认真分析图像的变化趋势,结...
 [方法与规律j] 氧化还原滴定小专题 作者:化学自习室 来源:未知 日期:2023-05-18 16:26:34 点击:346 所属专题:氧化还原反应滴定
[方法与规律j] 氧化还原滴定小专题 作者:化学自习室 来源:未知 日期:2023-05-18 16:26:34 点击:346 所属专题:氧化还原反应滴定
...
 [方法与规律j] pH值计算的思维路径 作者:化学自习室 来源:未知 日期:2022-12-19 17:46:23 点击:562 所属专题:pH计算
[方法与规律j] pH值计算的思维路径 作者:化学自习室 来源:未知 日期:2022-12-19 17:46:23 点击:562 所属专题:pH计算
一、原理:影响水的电离平衡因素 H 2 O H + +OH - 1.25 ℃, → c (H + ) H2O = c (OH - ) H2O =1×10 -7 → K w =1×10 -14 2.25 ℃,加CH 3 COOH、H + →平衡向左移动→ c (H + ) H2O = c (OH - ) H2O <1×10 -7 3.25 ℃,加NH 3 ·H 2 O、OH - →平衡向...
 [方法与规律j] 应用图示法分析混合溶液中的质子守恒 作者:化学自习室 来源:未知 日期:2022-12-12 10:23:00 点击:362 所属专题:质子守恒
[方法与规律j] 应用图示法分析混合溶液中的质子守恒 作者:化学自习室 来源:未知 日期:2022-12-12 10:23:00 点击:362 所属专题:质子守恒
...
 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
双指示剂法是一种利用两种具有不同变色范围的酸碱指示剂,在...
弱酸也可以制备强酸!!! 比如向 CuSO 4 溶液中加入 H 2 S 溶液生...
氧化还原滴定法: 1.特点: 氧化还原滴定法在药物分析中应用广...
问题1: 在酸溶液中,H + 和OH - 的来源分别是什么?举例说明...
电离平衡常数是高考中一个重要的必考考点,常考查电离平衡常...
...
一、原理:影响水的电离平衡因素 H 2 O H + +OH - 1.25 ℃,...
...