
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、沉淀溶解平衡中的常数(Ksp)——溶度积
1. 定义:在一定温度下,难溶电解质的饱和溶液中,存在沉淀溶解平衡,其平衡常数叫做溶度积常数(或溶度积)
2. 表示方法:以MmAn(s) ![]() mMn+(aq) + nAm-(aq)为例(固体物质不列入平衡常数),Ksp=[c(Mn+)]m·[c(Am-)] n,如AgCl(s)
mMn+(aq) + nAm-(aq)为例(固体物质不列入平衡常数),Ksp=[c(Mn+)]m·[c(Am-)] n,如AgCl(s)![]() Ag+(aq) + Cl-(aq),Ksp=c(Ag+)·c(Cl-)。
Ag+(aq) + Cl-(aq),Ksp=c(Ag+)·c(Cl-)。
3. 影响溶度积(Ksp)的因素:Ksp只与难容电解质的性质、温度有关,而与沉淀的量无关,并且溶液中的离子浓度的变化只能使平衡移动,并不改变溶度积。
4. 意义:①Ksp反映了难溶电解质在水中的溶解能力,当化学式所表示的阴、阳离子个数比相同时,Ksp数值越大的难溶电解质在水中的溶解能力相对越强;②可以用Ksp来计算饱和溶液中某种离子的浓度。
二、判断沉淀生成与否的原则——溶度积规则
通过比较溶度积与溶液中有关离子浓度幂的乘积——离子积(Qc)的相对大小,可以判断难溶电解质在给的条件下沉淀能否生成或溶解:
1.Qc>Ksp,溶液过饱和,既有沉淀析出,直到溶液饱和,达到新的平衡;
2.Qc=Ksp,溶液饱和,沉淀与溶解处于平衡状态;
3.Qc<Ksp,溶液未饱和无沉淀析出,若加入过量难溶电解质,难溶电解质溶解直至溶液饱和。
三、对溶度积的理解
1. 溶度积和溶解度都可以用来表示物质的溶解能力。
2. 用溶度积直接比较不同物质的溶解性时,物质的类型应相同。对于化学式中阴、阳离子个数比不同的难溶电解质,不能通过直接比较Ksp的大小来确定其溶解能力的大小。
3. 溶液中的各离子浓度的变化只能使沉淀溶解平衡移动,并不改变溶度积。
【例题1】下列对沉淀溶解平衡的描述正确的是
A. 反应开始时溶液中个离子浓度相等
B. 沉淀溶解达到平衡时,沉淀的速率和溶解的速率相等
C. 沉淀溶解达到平衡时,溶液中溶质的离子浓度相等,且保持不变
D. 沉淀溶解达到平衡时,如果再加入难溶性的该沉淀物,将促进溶解
解析:A项反应开始时,各离子的浓度没有必然的关系,因此错误;B项正确;C项沉淀溶解达到平衡时,溶液中溶质的离子浓度保持不变,但不一定相等;D项沉淀溶解达到平衡时,如果再加入难溶性的该沉淀物,由于固体的浓度为常数,故平衡不发生移动。
答案:B
点拨:沉淀平衡是化学平衡中的一种,在学习这部分知识时要注意化学平衡移动原理的应用。
四、影响沉淀平衡的因素
1. 内因:难溶电解质本身的性质。
2. 外因:①浓度,加水稀释沉淀平衡向溶解的方向移动,但Ksp不变。②温度,升高温度沉淀溶解平衡向吸热的方向移动,同时Ksp随温度的变化而变化。③同离子效应,向沉淀平衡体系中加入相同的离子,使平衡向沉淀方向移动,但Ksp不变。④向沉淀平衡体系中加入可与体系中某些离子反应生成更难溶物质或气体的分子,使平衡体向溶解的方向移动,但Ksp不变。
五、沉淀的生成与溶解
1. 沉淀生成的方法有:①加沉淀剂法:如以Na2S、H2S等作沉淀剂,可使某些金属离子如Cu2+、Hg2+等生成极难溶的硫化物CuS、HgS等沉淀,也是分离除去杂质的常用方法;②调节pH法:如在工业原料氯化铵中含杂质氯化铁,使其溶解于水,再加入氨水调节pH至7~8,可使Fe3+转变为Fe(OH)3沉淀而除去。
2. 沉淀溶解的方法有:①酸碱溶解法,如难溶于水的CaCO3沉淀可以溶于盐酸中;②盐溶解法,如Mg(OH)2可溶于NH4Cl溶液中:Mg(OH)2(s)![]() Mg2+(aq) + 2OH-(aq)、NH4++H2O
Mg2+(aq) + 2OH-(aq)、NH4++H2O![]() NH3·H2O+ H+、H++ OH-=== H2O。
NH3·H2O+ H+、H++ OH-=== H2O。
【例题2】(2011浙江高考)海水中含有丰富的镁资源。某同学设计了从模拟海水中制备MgO的实验方案:

模拟海水中的离子浓度(mol/L) | Na+ | Mg2+ | Ca2+ | Cl- | HCO3- |
0.439 | 0.050 | 0.011 | 0.560 | 0.001 |
注:溶液中某种离子的浓度小于1.0×10-5mol/L,可认为该离子不存在;实验过程中,假设溶液体积不变。
已知:KCaCO3)=4.96×10-9;Ksp(MgCO3)=6.82×10-6;Ksp[Ca(OH)2]=4.68×10-6;Ksp[Mg(OH)2]=5.61×10-12。下列说法正确的是
A.沉淀物X为CaCO3
B.滤液M中存在Mg2+,不存在Ca2+
C.滤液N中存在Mg2+、Ca2+
D.步骤②中若改为加入4.2 g NaOH固体,沉淀物Y为Ca(OH)2和Mg(OH)2的混合物
解析:步骤①发生Ca2++OH-+ HCO3-=== CaCO3↓+H2O;步骤②:Ksp[Mg(OH)2]=c(Mg2+)×(10-3)2=5.6×10-12,c(Mg2+)=5.6×10-6。Q[Ca(OH)2]=c(Ca2+)×(10-3)2=10-8<Ksp,无Ca(OH)2析出。A选项正确,生成0.001 mol CaCO3。B选项错误,剩余c(Ca2+)=0.001 mol/L。C选项错误,c(Mg2+)=5.6×10-6<10-5,无剩余,D选项错误,生成0.05 mol Mg(OH)2,余0.005 mol OH-,Q[Ca(OH)2]=0.01×0.0052=2.5×10-7<Ksp,无Ca(OH)2析出。
答案:A
点拨:本题考察方式很新颖,主要考察溶度积的计算和分析。解题时要能结合溶度积计算,分析推断沉淀是否产生。
答案:B、D
【例题3】(2010![]() 山东高考)某温度下,Fe(OH)3(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示。据图分析,下列判断错误的是
山东高考)某温度下,Fe(OH)3(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示。据图分析,下列判断错误的是

A. Ksp[Fe(OH)3]<Ksp[Cu(OH)2]
B. 加适量NH4Cl固体可使溶液由a点变到b点
C. c、d两点代表的溶液中c(H+)与c(OH-)乘积相等
D.Fe(OH)3、Cu(OH)2分别在b、c两点代表的溶液中达到饱和
解析:b、c两点金属阳离子的浓度相等,都设为x,c(OH-)c=10-9.6,c(OH-)b=10-12.7,则Ksp[Fe(OH)3]=x×(10-12.7)3,Ksp[Cu(OH)2]=x×(10-9.6)2,故Ksp[Fe(OH)3]<Ksp[Cu(OH)2],A正确;a点到b点的碱性增强,而NH4Cl溶解于水后显酸性,故B错;只要温度一定,Kw就一定,故C正确;溶度积曲线上的点代表的溶液都已饱和,曲线左下方的点都不饱和,右上方的点都是Q>K,沉淀要析出,故D正确。
答案:B
六、沉淀的转化
沉淀转化的实质就是沉淀溶解平衡的移动。一般来说,溶解度小的沉淀可以转化为溶解度更小的沉淀。如NaCl溶液和AgNO3溶液混合后会有白色沉淀AgCl生成,向该混合溶液中加入KI溶液后,白色沉淀就转化为黄色沉淀AgI,再向该混合液中加入Na2S溶液,黄色沉淀又转化为黑色Ag2S沉淀。有关转化的方程式:AgCl + KI === AgI↓+ KCl 2AgI + Na2S === Ag2S↓+ 2NaI
上述转化说明溶解度的大小关系是: AgCl>AgI>Ag2S
【例题4】(09广东![]() 高考)硫酸锶(SrSO4)在水中的深沉溶解平衡曲线如下。下列说法正确的是
高考)硫酸锶(SrSO4)在水中的深沉溶解平衡曲线如下。下列说法正确的是
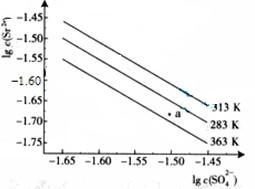
A. 温度一定时,Ksp(SrSO4)随c(SO42-)的增大而减小
![]() B. 三个不同温度中,313K时Ksp(SrSO4)最大
B. 三个不同温度中,313K时Ksp(SrSO4)最大
![]() C. 283K时,图中a点对应的溶液是不饱和溶液
C. 283K时,图中a点对应的溶液是不饱和溶液
![]() D. 283K下的SrSO4饱和溶液升温到363K后变为不饱和溶液
D. 283K下的SrSO4饱和溶液升温到363K后变为不饱和溶液![]()
![]() 解析:平衡常数只与温度有关,与物质的浓度无关,A错误;温度一定时Ksp=[Sr2+][SO42-],由图像可知:在相同条件下,温度越低,c(SO42-)·c(Sr2-)越大,Ksp(SrSO4)越大,B正确;a点在283K的下方,Qc小于Ksp(283K),属于不饱和溶液,C正确;283K下的SrSO4饱和溶液升温到363K后会有晶体析出,还是属于饱和溶液,D错。
解析:平衡常数只与温度有关,与物质的浓度无关,A错误;温度一定时Ksp=[Sr2+][SO42-],由图像可知:在相同条件下,温度越低,c(SO42-)·c(Sr2-)越大,Ksp(SrSO4)越大,B正确;a点在283K的下方,Qc小于Ksp(283K),属于不饱和溶液,C正确;283K下的SrSO4饱和溶液升温到363K后会有晶体析出,还是属于饱和溶液,D错。
![]() 答案:BC
答案:BC
【例题5】(2009浙江![]() 高考)已知:25°C时,Ksp[Mg(OH)2]=5.61×10-12,Ksp[MgF2]=7.42×10-11。下列说法正确的是
高考)已知:25°C时,Ksp[Mg(OH)2]=5.61×10-12,Ksp[MgF2]=7.42×10-11。下列说法正确的是
![]() A. 25°C时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大
A. 25°C时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大
![]() B. 25°C时,在Mg(OH)2的悬浊液加入少量的NH4Cl固体,c(Mg2+)增大
B. 25°C时,在Mg(OH)2的悬浊液加入少量的NH4Cl固体,c(Mg2+)增大
![]() C. 25°C时,Mg(OH)2固体在20 mL 0.01 mol/L氨水中的Ksp比在20mL 0.01mol/L NH4Cl溶液中的Ksp小
C. 25°C时,Mg(OH)2固体在20 mL 0.01 mol/L氨水中的Ksp比在20mL 0.01mol/L NH4Cl溶液中的Ksp小
![]() D. 25°C时,在Mg(OH)2的悬浊液加入NaF溶液后,Mg(OH)2不可能转化成为MgF2
D. 25°C时,在Mg(OH)2的悬浊液加入NaF溶液后,Mg(OH)2不可能转化成为MgF2
![]() 解析:因为Mg(OH)2的溶度积小,故其电离出的Mg2+浓度要小一些,故A项错;NH4+可以结合Mg(OH)2电离出的OH-离子,从而促使Mg(OH)2的电离平衡正向移动,c(Mg2+)增大,故B项正确;C项Ksp仅与温度有关,故错;D项,由于MgF2的溶度积更小,所以沉淀会向更难溶的方向进行,即可以生成MgF2沉淀。
解析:因为Mg(OH)2的溶度积小,故其电离出的Mg2+浓度要小一些,故A项错;NH4+可以结合Mg(OH)2电离出的OH-离子,从而促使Mg(OH)2的电离平衡正向移动,c(Mg2+)增大,故B项正确;C项Ksp仅与温度有关,故错;D项,由于MgF2的溶度积更小,所以沉淀会向更难溶的方向进行,即可以生成MgF2沉淀。
![]() 答案:B
答案:B
七、巩固练习
练习1.(08年山东高考)某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是
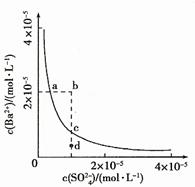
(提示:BaSO4(s)![]() Ba2+(aq)+SO42-(aq)的平衡常数Ksp=c(Ba2+)·c(SO42-),称为溶度积常数。)
Ba2+(aq)+SO42-(aq)的平衡常数Ksp=c(Ba2+)·c(SO42-),称为溶度积常数。)
A. 加入Na2SO4可以使溶液由a点变到b点
B. 通过蒸发可以使溶液由d点变到c点
C. d点无BaSO4沉淀生成
D. a点对应的Ksp大于c点对应的Ksp
解析:A项,当加入Na2SO4溶液时,c(SO42-)增大,因Ksp为常数,则c(Ba2+)就会减小,故A错;B项,蒸发可以会使溶液的c(SO42-)和c(Ba2+)都变大,故B错;C项,在d点时,因其在沉淀溶解平衡点c点的下方,c(Ba2+)较小,故它们浓度的乘积小于Ksp,则无无BaSO4沉淀生成,C正确;D项,因a、c两点对应的都是在相同的温度下的Ksp,故二者的Ksp相同,D错。
答案:C
练习2.(2010年浙江高考)已知:①25℃时弱电解质电离平衡数:Ka(CH3COOH)=1.8×10-5,Ka(HSCN)=0.13;难溶电解质的溶度积常数:Kap(CaF2)=1.5×10-10;②25℃时,2.0×10-3mol·L-1氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系,如下图所示:
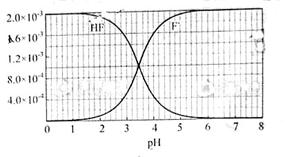
请根据以下信息回答下旬问题:
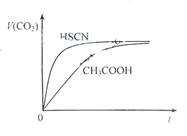
(1)25℃时,将20mL 0.10 mol·L-1 CH3COOH溶液和20mL 0.10 mol·L-1HSCN溶液分别与20mL 0.10 mol·L-1NaHCO3溶液混合,
实验测得产生的气体体积(V)随时间(t)变化的示意图为图2所示:反应初始阶段,两种溶液产生CO2气体的速率存在明显差异的原因是 ,反应结束后所得两溶液中,c(CH3COO-) c(SCN-)(填“>”、“<”或“=”)
(2)25℃时,HF电离平衡常数的数值Ka≈ ,列式并说明得出该常数的理由 。
(3)4.0×10-3mol·L-1HF溶液与4.0×10-4mol·L-1CaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化),通过列式计算说明是否有沉淀产生。
解析:信息分析:①HSCN比CH3COOH易电离,CaF2难溶。②F-:pH=6,pH=0时以HF存在。F-与HF总量不变。(1)相同的起始条件,只能是因为两种酸的电离度不同导致溶液中起始反应时H+浓度不同引起反应速率的不同。反应结束后,溶质为CH3COONa和NaSCN,因CH3COOH酸性弱于HSCN,故CH3COONa水解程度大,c(CH3COO-)<c(SCN-)。(2)HF电离平衡常数Ka=[c(H+)× c (F-)]/ c(HF),其中c(H+)、c (F-)、c(HF)都是电离达到平衡时的浓度,选择中间段图像求解。根据图像:pH=4时,c(H+)=10-4,c (F-)=1.6×10-3、 c(HF)=4.0×10-4。Ka=0.4×10-3。(3)pH=4.0,则c(H+)=10-4,此时:根据HF电离,产生的c (F-)=1.6×10-3,而溶液中的c(Ca2+)=2.0×10-4。
C2(F-)×c(Ca2+)=5.12×10-10,5.12×10-10大于Kap(CaF2)=1.5×10-10少量沉淀产生。
点拨:本题给出的信息多,先对信息进行初步分析,也可以根据问题再去取舍信息。比较全面地考察了电离平衡常数与溶解平衡常数的知识内容。要求会读图,掌握平衡常数的表达式和含义:达到饱和溶液时的最大值,大于则沉淀析出,小于则不析出。明确平衡常数是随温度变化的,不随溶液中的离子浓度的实际值而发生变化。在平衡常数的学习中,可以对比化学平衡常数、电离平衡常数、沉淀溶解平衡常数,有触类旁通地系统地研究和学习平衡常数问题。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。双指示剂法是一种利用两种具有不同变色范围的酸碱指示剂,在滴定过程中分别指示两个不...
弱酸也可以制备强酸!!! 比如向 CuSO 4 溶液中加入 H 2 S 溶液生成 CuS 黑色沉淀和 ...
氧化还原滴定法: 1.特点: 氧化还原滴定法在药物分析中应用广泛,用于测定具有氧化性...
问题1: 在酸溶液中,H + 和OH - 的来源分别是什么?举例说明怎样计算由水电离产生...
电离平衡常数是高考中一个重要的必考考点,常考查电离平衡常数的计算、弱酸的相对强弱...
...