
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
弱酸也可以制备强酸!!!
比如向CuSO4溶液中加入H2S溶液生成CuS黑色沉淀和H2SO4溶液的反应,其化学方程式:
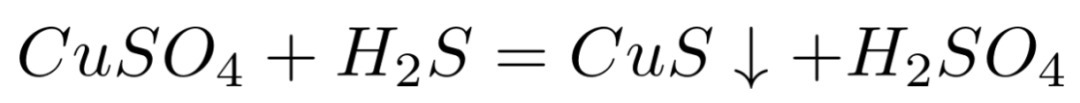
对应的离子方程式:
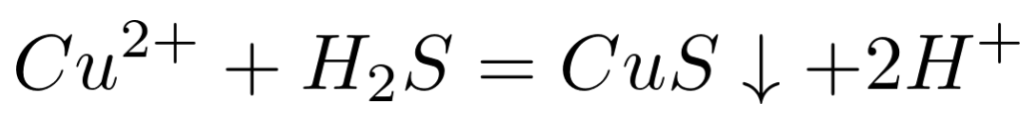
该反应的平衡常数表达式为:
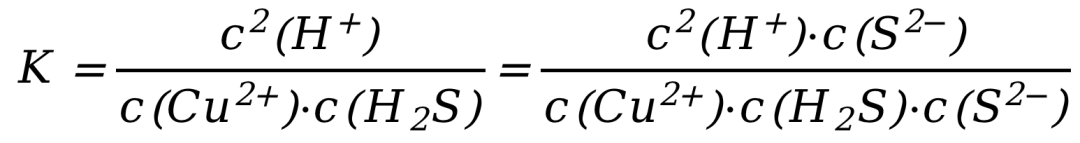
这里需要用到一些式子处理的技巧,我刚刚在分子分母同乘了一个C(S2-),分数值不变。
这个方法有的教材称之为“凑K法”,实际就是一个简单的分数性质。
整个溶液体系里存在化学反应有:
H2S(弱酸,部分电离)的电离:
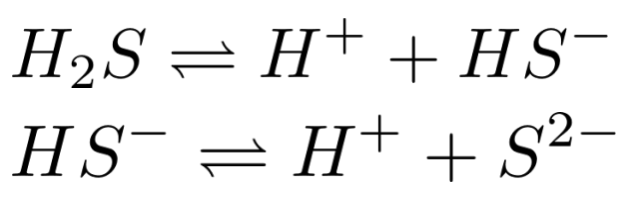
对应的平衡常数:
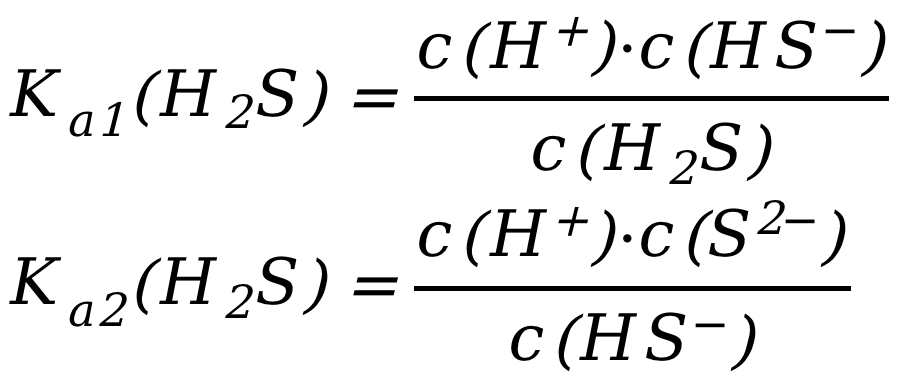
还存在CuS这个难溶电解质的溶解平衡:
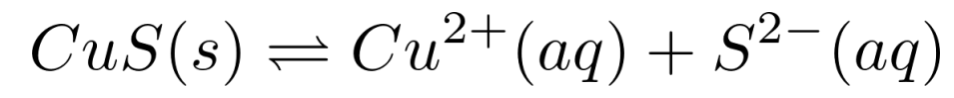
对应的平衡常数:
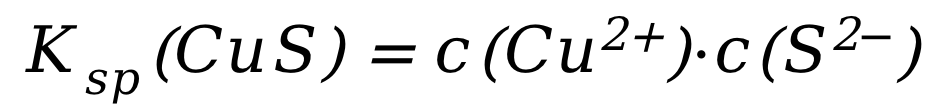
所以整个反应的K可以转化为:
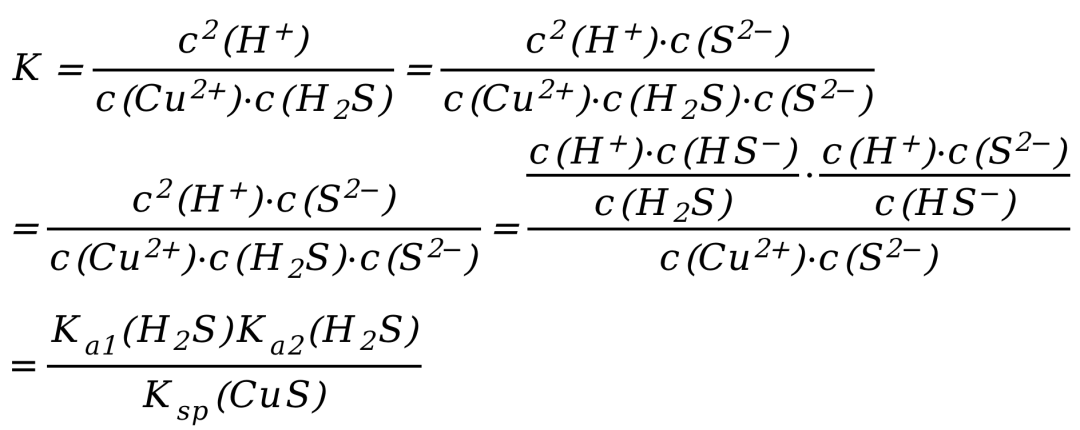
由于Ka1(H2S)=1.3×10-7,Ka2(H2S)=7.1×10-15,Ksp(CuS)=6.3×10-36,所以带入K的关系式计算出CuSO4与H2S反应的平衡常数K=1.5×1014,反应可以自发进行,最终实现了弱酸制备强酸。
这个反应之所以可以进行的原因是生成了难溶于水的CuS。
以上的计算也相当于从微观角度解释了化学反应的本质,也用到了勒夏特列原理。
所以,高中化学一个比较高阶的学习方法是理解、计算、推导那些结论。自此,那些结论不再是冰冷的教条一般的存在,而是变成了可计算、可推导的更加具象的存在。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
双指示剂法是一种利用两种具有不同变色范围的酸碱指示剂,在...
弱酸也可以制备强酸!!! 比如向 CuSO 4 溶液中加入 H 2 S 溶液生...
氧化还原滴定法: 1.特点: 氧化还原滴定法在药物分析中应用广...
问题1: 在酸溶液中,H + 和OH - 的来源分别是什么?举例说明...
电离平衡常数是高考中一个重要的必考考点,常考查电离平衡常...
...