
|
学习小专题 |

|
学习小专题 |
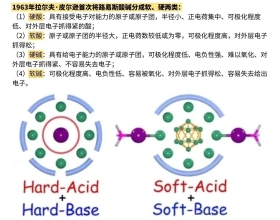 [注解与辨疑j] 什么是软硬酸碱理论? 作者:化学自习室 来源:未知 日期:2026-02-04 12:53:57 点击:101 所属专题:软硬酸碱理论
[注解与辨疑j] 什么是软硬酸碱理论? 作者:化学自习室 来源:未知 日期:2026-02-04 12:53:57 点击:101 所属专题:软硬酸碱理论
什么是“软硬酸碱理论”,1963 年,拉尔夫・皮尔逊提出软硬酸碱理论,该理论是路易斯酸碱理论的重要补充,核心是按照酸、碱的结构与性质将其分为硬、软两类,还有介于二者之间的交界酸...
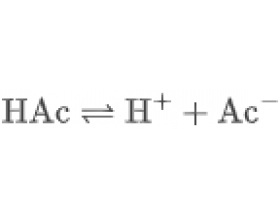 [注解与辨疑j] 缓冲溶液:化学体系中的“pH稳定器” 作者:化学自习室 来源:未知 日期:2025-12-31 10:27:31 点击:654 所属专题:缓冲溶液
[注解与辨疑j] 缓冲溶液:化学体系中的“pH稳定器” 作者:化学自习室 来源:未知 日期:2025-12-31 10:27:31 点击:654 所属专题:缓冲溶液
在高中化学教学中,缓冲溶液是一个重要概念。它不仅体现了酸碱平衡的动态特性,还广泛应用于生物、医学、环境和工业等多个领域。 一、什么是缓冲溶液? 缓冲溶液是指由弱酸与其共轭碱(如 HAc 与 NaAc)或弱碱与其共轭酸(如 NH·HO 与 NHCl)组成的混合溶液,能够在加入少...
 [注解与辨疑j] 铵根离子与碳酸氢根离子为什么可以大量共存? 作者:化学自习室 来源:未知 日期:2025-12-31 10:23:28 点击:677 所属专题:双水解反应
[注解与辨疑j] 铵根离子与碳酸氢根离子为什么可以大量共存? 作者:化学自习室 来源:未知 日期:2025-12-31 10:23:28 点击:677 所属专题:双水解反应
水溶液中NH水解显酸性,CO、HCO水解显碱性,二者会发生“相互促进的双水解”,但这种促进程度未达到“完全水解”(完全水解会导致离子无法大量共存,如Al与HCO),双水解的水解度仅1%~5%(注意是综合水解度,不是单个反应,考虑了CO水解之后的HCO进一步水解),因此常温下三种离...
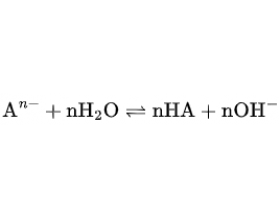 [注解与辨疑j] 为什么某些盐类水解能进行彻底? 作者:化学自习室 来源:未知 日期:2025-12-24 10:27:44 点击:617 所属专题:双水解反应
[注解与辨疑j] 为什么某些盐类水解能进行彻底? 作者:化学自习室 来源:未知 日期:2025-12-24 10:27:44 点击:617 所属专题:双水解反应
在基础化学中,我们常被告知:盐类水解通常是微弱且可逆的。例如,醋酸钠(CH 3 COONa)溶于水后呈碱性,是因为 CH 3 COO - 与水反应生成少量 CH 3 COOH 和 OH - ;氯化铵(NH 4 Cl)溶液呈酸性,则是 NH 4 + 解产生 H 的结果。这些反应都存在明确的化学平衡,水解程度有限。...
 [注解与辨疑j] 溶度积小的沉淀如何转化为溶度积较大的沉淀? 作者:化学自习室 来源:未知 日期:2025-12-15 16:14:18 点击:544 所属专题:沉淀转化
[注解与辨疑j] 溶度积小的沉淀如何转化为溶度积较大的沉淀? 作者:化学自习室 来源:未知 日期:2025-12-15 16:14:18 点击:544 所属专题:沉淀转化
一般来说,溶解度大的物质易转化为溶解度小的物质。那反过来有没有可能是溶解度小的物质向溶解度大的物质转化呢?如有可能,要具备什么样的条件呢? 如,在1.0 L NaCO溶液中,溶解 0.01mol 的 BaSO,所需 NaCO溶液的浓度最小是多少? 【分析】要溶解0.01 mol BaSO在1.0 L Na...
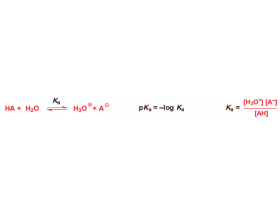 [注解与辨疑j] pH与pKa解读 作者:化学自习室 来源:未知 日期:2025-11-25 17:44:03 点击:765 所属专题:pKa ph值
[注解与辨疑j] pH与pKa解读 作者:化学自习室 来源:未知 日期:2025-11-25 17:44:03 点击:765 所属专题:pKa ph值
一.定义 1.pH pH=–log[H] pH是衡量溶液整体酸碱度的指标,具体指溶液中氢离子浓度([H])的负对数,其数值大小直接反映溶液酸碱性的强弱(如pH=7为中性,pH7为酸性,pH7为碱性)。 2.pKa pKa是衡量酸释放氢离子(H)能力的指标,具体指酸的解离常数(Ka)的负对数,其...
 [注解与辨疑j] 水解反应都是吸热的吗? 作者:化学自习室 来源:未知 日期:2025-11-07 09:20:06 点击:745 所属专题:水解反应
[注解与辨疑j] 水解反应都是吸热的吗? 作者:化学自习室 来源:未知 日期:2025-11-07 09:20:06 点击:745 所属专题:水解反应
盐类的水解是中和反应的逆反应,所以,一般地,盐类的水解反应是吸热的。 但也有特殊的,比如AlS、MgN、CaN、CaP、AlC等遇水剧烈水解,反应放热显著。 AlS+6HO=2Al(OH)↓+3HS↑, MgN+6HO=3Mg(OH)+2NH↑, CaP + 6HO = 3Ca (OH)↓ + 2pH↑ AlC + 12HO = 4Al (OH)...
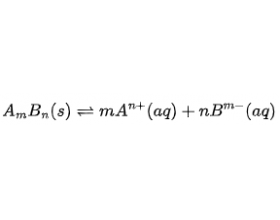 [注解与辨疑j] 溶解度与溶度积常数的关系 作者:化学自习室 来源:未知 日期:2025-11-05 10:55:52 点击:741 所属专题:溶解度 溶度积
[注解与辨疑j] 溶解度与溶度积常数的关系 作者:化学自习室 来源:未知 日期:2025-11-05 10:55:52 点击:741 所属专题:溶解度 溶度积
溶解度(Solubility)与溶度积常数(Solubility Product Constant, ksp密切相关,但二者概念不同、单位不同、适用范围不同。它们之间的关系可以通过沉淀-溶解平衡建立,并在理想稀溶液、无副反应的假设下进行定量换算。下面结合具体实例详细说明。 一、基本概念 项目 溶...
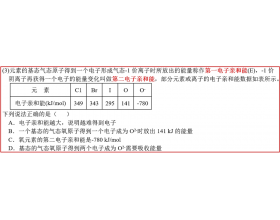 [注解与辨疑j] 什么是第一电子亲和能? 作者:化学自习室 来源:未知 日期:2025-10-11 10:29:06 点击:983 所属专题:电子亲和能
[注解与辨疑j] 什么是第一电子亲和能? 作者:化学自习室 来源:未知 日期:2025-10-11 10:29:06 点击:983 所属专题:电子亲和能
【导读】与第一电离能定义相反(并非严格互逆过程),第一电子亲和能是指基态的气态原子(或离子)获得一个电子形成气态阴离子时所放出或吸收的能量,通常用符号E表示,单位kJ/mol,它反映出原子(或离子)获取电子的能力。 简单理解:第一电子亲和能衡量的是一个气态原子“渴...
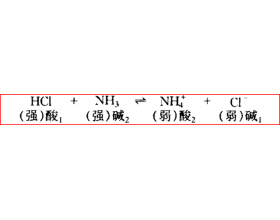 [注解与辨疑j] 什么是共轭酸碱对? 作者:化学自习室 来源:未知 日期:2025-10-11 10:08:10 点击:926 所属专题:酸碱理论
[注解与辨疑j] 什么是共轭酸碱对? 作者:化学自习室 来源:未知 日期:2025-10-11 10:08:10 点击:926 所属专题:酸碱理论
【导读】 根据 质子酸碱 理论: 酸是 质子的给予体 , 给出质子 (H ) 的物质 ; 碱是 质子的接受体 , 得到质子 (H ) 的物质 。 当一个酸 (HA) 给出一个质子 (H ) 后,剩余的部分 (A ) 就具备了接受质子的能力,成为该酸的 “ 共轭碱 ” ;当一个碱 (B) 得到一个质子 (H...
 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
什么是“软硬酸碱理论”,1963 年,拉尔夫・皮尔逊提出软硬酸...
水溶液中NH水解显酸性,CO、HCO水解显碱性,二者会发生“相互促...
在基础化学中,我们常被告知:盐类水解通常是微弱且可逆的。...
一般来说,溶解度大的物质易转化为溶解度小的物质。那反过来...
一.定义 1.pH pH=–log[H] pH是衡量溶液整体酸碱度的指标,具体指溶...
溶解度(Solubility)与溶度积常数(Solubility Product Constant, ksp密切...
【导读】与第一电离能定义相反(并非严格互逆过程),第一电子...
【导读】 根据 质子酸碱 理论: 酸是 质子的给予体 , 给出质子...