
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
[规律1]根据“强置换弱”的反应规律和一元弱酸的电离度(或电离常数)可得出如下弱酸的强弱顺序:HNO2>HF>HCOOH>C6H5COOH>CH3COOH>HClO>HCN>C6H5OH>HAlO2。依此可判断一元弱酸与一元弱酸盐是否发生反应及其反应的产物。
[规律2]在确定弱酸与多元弱酸盐反应的产物时应首先写出两反应物电离和水解的产物,然后再排出这些产物酸性的强弱顺序(通常按“一隔一”排列),顺序表中两边的物质能相互反应,生成相邻的一对中间产物,即左边的反应物足量时生成靠左物的一对,右边反应物足量时生成靠右物的一对。
[例1]写出以下三组溶液混合后反应的方程式:
(1)HNO2与NaCN;(2)HCOOH与![]() ;(3)HF与CH3COONa。
;(3)HF与CH3COONa。
解析:根据规律1可写出:
(1)HNO2+NaCN=NaNO2+HCN;
(2)HCOOH+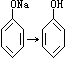 +HCOONa;
+HCOONa;
(3)HF+CH3COONa=CH3COOH+NaF。
[例2]写出CH3COOH与Na3PO4两溶液反应的方程式。
解析:根据规律2应首先排出两反应物电离和水解产物酸性的强弱顺序:
![]()
(1)当CH3COOH足量时,反应按①进行,2CH3COOH+Na3PO4=NaH2PO4+2CH3COONa。
(2)当Na3PO4足量时,反应按②进行,即CH3COOH+Na3PO4=CH3COONa+Na2HPO4。
[例3]写出H3PO4与Na2CO3溶液反应的方程式。
解析:酸性强弱顺序:
![]()
(1)当H3PO4足量时,①2H3PO4+Na2CO3=2NaH2PO4+CO2↑+H2O。
(2)当Na2CO3足量时,②H3PO4+2Na2CO3=Na2HPO4+2NaHCO3。
[例4]将SO2通入Na2CO3溶液中,写出它们反应的方程式。
解析:
![]()
SO2足量时,①2SO2+H2O+Na2CO3=2NaHSO3+CO2。
Na2CO3足量时,②SO2+H2O+2Na2CO3=Na2SO3+2NaHCO3。
[例5]将CO2分别通入(1)NaAlO2溶液、(2)NaClO溶液、(3)苯酚钠溶液中,写出各自反应的方程式。
解析:(1)
![]()
CO2足量时,①NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3。
NaAlO2足量时,②2NaAlO2+CO2+3H2O=2Al(OH)3↓+Na2CO3。
(2)![]()
不管CO2是否足量,只能是NaClO+CO2+H2O=NaHCO3+HClO。
(3)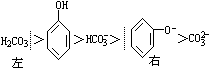
不管CO2是否足量,只能是![]() +CO2+H2O→
+CO2+H2O→![]() +NaHCO3。
+NaHCO3。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
双指示剂法是一种利用两种具有不同变色范围的酸碱指示剂,在...
弱酸也可以制备强酸!!! 比如向 CuSO 4 溶液中加入 H 2 S 溶液生...
氧化还原滴定法: 1.特点: 氧化还原滴定法在药物分析中应用广...
问题1: 在酸溶液中,H + 和OH - 的来源分别是什么?举例说明...
电离平衡常数是高考中一个重要的必考考点,常考查电离平衡常...
...