
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
酸碱理论对于无机化学来说是极其重要的组成 部分,不同的理论对于酸碱有不同的定义。在众多理论中,最普遍使用的一种是路易斯酸碱理论。我们可 以利用路易斯酸碱理论作为分析各类反应时的思路.。本文将简单地对比其他2种常见的理论与路易斯理 论的不同,并举例说明路易斯酸碱理论的应用方法.
1阿伦尼乌斯理论与质子酸碱理论
第一次在课堂上接触到“酸碱”概念是在初三,当时对酸的定义是,电离出来的阳离子全是H+的物质 就是酸;电离出来的阴离子全是OH-的物质就是碱。这种定义方法与阿伦尼乌斯酸碱理论相似,这种理论在计算中的应用非常广泛,因为在水溶液中H+和 OH-的浓度是可以测量的。酸碱的强度随H+和 OH-的浓度变化而变化,于是根据这种理论定义了溶 液的pH,酸碱的强度得以量化。但是,这种理论只能 在酸碱的水溶液中使用,对那些不溶于水却能表现出 酸碱性的物质,阿伦尼乌斯理论不能对其进行分析.。例如,气态的NH3在这种理论中就不是碱了,因为它 不能直接电离出OH-。
后来,我们学到了布朗斯特和劳里提出的质子酸碱理论,弥补了一些阿伦尼乌斯理论中的不足。质子 酸碱理论认为,能接受质子(H+)的物质是碱,能提供质子的物质是酸.在酸提供质子后,剩下的就是它的共轭碱;同理,在碱接受质子后,生成的就是它的共轭 酸。这种理论比起阿伦尼乌斯理论适用的范围更大, 有效地被应用于非水溶液中对酸碱的分析。例如, NH3(g)+HCl(g) = NH4Cl(s)中,NH3 接受了 HCl 提供的质子,即使它不能电离出OH-,也表现出碱的性质。不过,质子酸碱理论也有不能解决的问题,与阿伦尼乌斯理论一样,它对酸碱的定义依赖于H+的存 在,所以对于不含H+的酸碱而言,质子酸碱理论也无能为力。如,BF3+NH3 =BF3NH3,其中反应物甚至都不含氢元素,但仍能体现出酸碱的性质.
2强大的路易斯酸碱理论
对于不含氢元素的酸碱我们该如何分析呢?美国化学家路易斯认为酸不一定要局限于含氢化合物中。根据路易斯酸碱理论的定义,提供电子对的物质 是碱,接受电子对的物质是酸。当路易斯酸与路易斯碱反应时,酸接受碱的电子对,形成配位键。这种理论的研究范围包含了所有之前提到的酸碱理论,并且解 释了许多不含质子的物质表现出酸性的原因。根据路易斯酸碱理论分析可知,许多质子酸都不是路易斯酸,比如说HNO3,HNO3分子在反应中不能接受电 子,也不能提供电子,所以它既不是路易斯酸也不是 路易斯碱。其实,HNO3在路易斯酸碱理论中属于酸碱加合物,因为H++NO3-→HNO3,在这里H+是 酸,NO3-是碱。常见的路易斯酸有金属阳离子和BF3、 AlCl3等缺电子化合物;常见的路易斯碱包括各种带孤对电子的中性分子,如NH3、甲醇等。图1是NH3 与BF3反应的结构式。
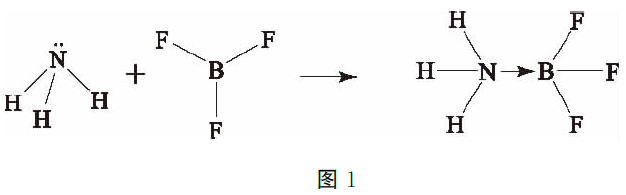
其中,NH3的一对孤对电子与BF3的中心原子配位, 形成酸碱络合物,NH3为电子给体,BF3为电子受体.
BF3是一种典型的缺电子化合物,这类化合物的中心原子是缺电子原子,也就是说它的价电子数小于价层轨道数。硼的电子构型是1s22s2p1,其中2s和 2p是价层轨道,2s与2p共有4个轨道,而硼的价电 子是3个。在三氟化硼中,由于F的影响,硼的一个2s电子被激发到空的2p轨道,杂化后形成3个sp2杂 化轨道。由于B的2p轨道中仍然没有电子,所以BF3 是可以接受电子对的路易斯酸。同理,对于NH3来 说,氮的价电子数大于价层轨道数,属于富电子原子, 所以在以上的反应中能提供电子对,是路易斯碱。另 外,NH3能与许多金属离子配位形成化合物。在这类 反应中,金属阳离子接受了 NH3的电子对,所以络合反应也可以视为路易斯酸碱加合反应。
除此之外,路易斯酸碱理论在有机化学中也有不少应用。在有机化学中,亲电试剂是路易斯酸,亲核试 剂是路易斯碱。以SN1亲核取代反应为例,如图2 所示。
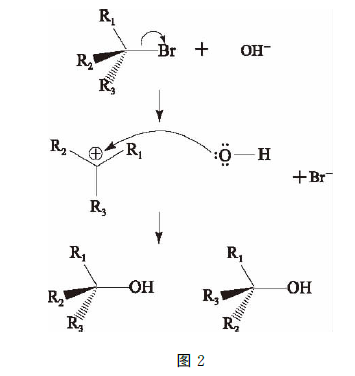
由于R1、R2和R3的空间位阻效应,离去基团 Br-需要先获得C—Br键的电子对才能进行下一步 反应。Br-离去后形成了一个三级碳正离子,在路易斯 酸碱理论中是一种路易斯酸。之前提到的OH-为亲核试剂,是典型的路易斯碱,所以路易斯酸碱配位,形成2种生成物(因为亲核试剂可以从不同的两面进攻 三级碳正离子,所以产生了手性异构分子)。由于酸碱 中和反应速率极快,所以总体的反应速率可以视为 Br-的离去的速率。
路易斯酸碱理论是目前应用范围最广泛的酸碱 理论,它能以酸碱的概念解释各种无机和有机的反 应。它最大的优点是无所不包,因为从电子对转移的 角度可以分析几乎所有反应。当然,没有什么理论是万能的。
路易斯酸碱理论的不足在于它对酸碱没有定量 计算的标准,不能比较酸碱的强弱,所以在需要计算 的情况下难以使用。不过,后来皮尔逊提出的软硬酸 碱理论弥补了路易斯酸碱理论的不足。通过结合这2 种理论,我们可以在分析电子对的提供与接受的同时 判断反应的方向和生成物的稳定性。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
酸碱指示剂是检验溶液酸碱性的常用化学试剂,像科学上的许多...
如果那一只手没有颤抖 我不会发现我难受 怎么配溶液也不会是...
酸碱理论对于无机化学来说是极其重要的组成 部分,不同的理论...
我国最新的《生活饮用水卫生标准》即将于7月1日实施。该《标...
水是人体体液的主要成分,是机体代谢反应的基...
酸、碱、盐是古代人们早已知道的。醋酸可以说是古代人知道最...