
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
在基础化学中,我们常被告知:盐类水解通常是微弱且可逆的。例如,醋酸钠(CH3COONa)溶于水后呈碱性,是因为 CH3COO-与水反应生成少量 CH3COOH 和 OH-;氯化铵(NH4Cl)溶液呈酸性,则是NH4+解产生 H⁺ 的结果。这些反应都存在明确的化学平衡,水解程度有限。
然而,现实中却存在一类“反常”的盐——它们一旦接触水,便剧烈反应、迅速分解,甚至伴随气体释放、沉淀生成,乃至直接形成金属氧化物,反应进行得如此彻底,以至于无法在水溶液中稳定存在。例如,硫化铝(Al2S3)遇水立即产生臭鸡蛋气味的H2S 气体和白色Al(OH)3 沉淀;四氯化钛(TiCl4)遇水则瞬间生成白色 TiO2·nH2O 凝胶。
那么,为什么某些盐类的水解能进行彻底?其背后的热力学与动力学机制是什么?又有哪些判断标准、常见误区?
一、水解的本质:弱电解质驱动的离子-水相互作用
盐类水解的本质,是弱酸的阴离子或弱碱的阳离子与水发生质子转移反应,生成对应的弱酸或弱碱:
阴离子水解(弱酸根):
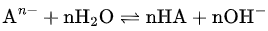
阳离子水解(弱碱阳离子):
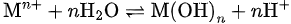
这类反应之所以可逆,是因为生成的HA、M(OH)n仍以分子或胶体形式存在于溶液中,体系很快达到动态平衡。此时,水解程度由水解常数 Kh决定,通常远小于 1。
关键点:普通盐类水解不彻底,是因为产物未脱离反应体系。
二、水解彻底的原因:打破化学平衡
要使水解反应“进行到底”,必须破坏可逆平衡。根据勒沙特列原理(LE CHATELiEr’S PrInCIPLE),若能持续移除产物,反应将不断向右推进。在盐类水解中,实现这一点的途径主要有两种:
1.气体逸出:降低产物浓度
当水解生成的弱酸或弱碱极不稳定,易分解为气体并从溶液中逸出时,逆反应几乎无法发生。常见气体包括:
H₂S(来自 S²⁻)
NH₃(来自 N³⁻)
CO₂(来自 CO₃²⁻/HCO₃⁻)
CH₄、C₂H₂、pH₃、SiH₄等(来自碳化物、磷化物、硅化物)
2.沉淀析出:锁定水解产物
许多高价金属离子(如 Al³⁺、Fe³⁺、Cr³⁺)水解生成的氢氧化物溶解度极低(Ksp ≈ 10-38~10-33,一旦形成即以沉淀形式析出,不再参与逆反应。
若水解产物中同时包含“气体↑”和“沉淀↓”,则水解极可能彻底。
三、高价金属阳离子的特殊行为
值得注意的是,某些高价态金属阳离子的水解不仅彻底,而且最终产物并非氢氧化物,而是金属氧化物或其水合物。
1.水解-脱水路径
高价金属离子(如 Ti⁴⁺、Sn⁴⁺、Zr⁴⁺、Al³⁺、Fe³⁺)具有高电荷密度,对配位水分子强烈极化,导致快速水解。初始产物虽常写作 M(OH)ₙ,但在以下条件下会自发脱水形成更稳定的氧化物: 加热或煮沸;长时间陈化(老化);水热环境(高温高压);低水活度或高 pH;
通式可表示为:
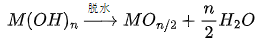
2.典型实例
金属离子 | 初始水解产物 | 最终产物 (加热/老化后) | 反应示例 |
|---|---|---|---|
Al³⁺ | Al(OH)₃(凝胶) | γ-Al₂O₃ 或 α-Al₂O₃ | |
Fe³⁺ | Fe(OH)₃ | α-Fe₂O₃(赤铁矿) | |
Ti⁴⁺ | H₂TiO₃ /TiO(OH)₂ | TiO₂(锐钛矿/金红石) | |
Sn⁴⁺ | Sn(OH)₄ | SnO₂ |
特别说明:Ti⁴⁺、Zr⁴⁺ 等 +4 价离子几乎不能以自由水合离子形式存在于水中,其“水解”本质上是直接形成水合氧化物沉淀,结构上已接近 MO₂。
3.为何高价态更倾向形成氧化物?
高晶格能:M-O 键比 M-OH 更强,氧化物热力学更稳定;
强极化能力:高电荷小半径离子使 O-H 键易断裂,促进脱水;
结构本质:许多所谓“氢氧化物”实为 [M-O-M] 网络骨架 + 吸附水,本质是无定形氧化物水合物。
应用意义:这一过程是溶胶-凝胶法、水热合成法制备纳米金属氧化物(如 TiO₂ 光催化剂、Al₂O₃ 陶瓷载体)的化学基础。
四、典型彻底水解的盐类及其反应机理
最典型的彻底水解往往源于双水解效应——即阳离子和阴离子同时强烈水解,且互相促进。
Al³⁺是强 Lewis 酸,极易结合 OH⁻ 形成 Al(OH)₃(或进一步脱水为 Al₂O₃);
CO₃²⁻、S²⁻、HCO₃⁻是强碱性阴离子,易结合 H⁺ 生成 H₂CO₃ 或 H₂S,进而分解为气体。
二者共存时,Al³⁺ 水解产生的 H⁺ 被 CO₃²⁻ 消耗,CO₃²⁻ 水解产生的 OH⁻ 被 Al³⁺ 消耗,形成正反馈循环,最终导致反应不可逆。
应用实例:泡沫灭火器正是利用Al₂(SO₄)₃ 与 NaHCO₃ 混合,瞬间产生大量 CO₂ 和 Al(OH)₃ 泡沫。
以下是一些具有代表性的“彻底水解”化合物:
化合物 | 水解反应式 | 产物特征 |
|---|---|---|
Al₂S₃ | 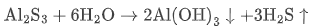 | 沉淀 + 有毒气体 |
Mg₃N₂ | 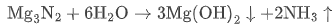 | 沉淀 + 碱性气体 |
TiCl₄ | 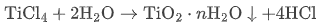 | 白色水合氧化物凝胶 + 强酸 |
Al⁴C₃ | 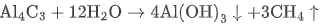 | 沉淀 + 可燃气体 |
Al³⁺/HCO₃⁻ | 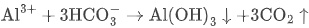 | 双水解协同 |
注意:像 Al₂S₃、TiCl₄ 这类物质不能通过水溶液复分解反应制备,必须采用干法或无水条件合成。
五、常见误区与边界情况
尽管有清晰规律,但在实际判断中仍存在若干“灰色地带”或易错情形:
1.并非所有弱酸弱碱盐都水解彻底
醋酸铵(CH₃COONH₄):虽含 NH₄⁺ 和 CH₃COO⁻,但水解产物 NH₃ 和 CH₃COOH 多数留在溶液中,无气体逸出或沉淀生成,仍为可逆平衡。
结论:必须有产物脱离体系,否则只是“较强的部分水解”。
2.(NH₄)₂CO₃ 的“准彻底”行为
它在水中会缓慢释放 NH₃ 和 CO₂,看似彻底,但本质是热力学不稳定的盐自发分解,严格来说不属于“水解”,而是水促进的分解反应。
3.共价卤化物(如 SiCl₄、TiCl₄)不是典型“盐”
它们是共价化合物,但遇水剧烈水解生成氧化物水合物。虽然教学中常归入“彻底水解”案例,但需注意其非离子晶体本质。
4.动力学阻碍:热力学可行 ≠ 实际发生
某些磷化物(如 AlP)理论上应彻底水解,但若表面致密钝化,反应速率极慢,在短期内表现为“稳定”。
六、总结
为避免误判,可按以下步骤分析:
1.识别离子来源:
是否含 Al³⁺、Fe³⁺、Ti⁴⁺ 等高价阳离子?是否含 S²⁻、CO₃²⁻、N³⁻ 等强水解阴离子?
2.预测水解产物:
是否有↓沉淀(如 Al(OH)₃)、↑气体(如 H₂S、NH₃),或直接形成氧化物凝胶(如 TiO₂·nH₂O)?
3.判断是否脱离体系:
气体能否逸出?沉淀或氧化物是否难溶且稳定?
4.考虑后续转化:
氢氧化物是否会脱水成氧化物(尤其在加热条件下)?
“有气有沉,水解成真;高价金属,氧化物稳;无气无沉,可逆平衡。”

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
水溶液中NH水解显酸性,CO、HCO水解显碱性,二者会发生“相互促...
在基础化学中,我们常被告知:盐类水解通常是微弱且可逆的。...
一般来说,溶解度大的物质易转化为溶解度小的物质。那反过来...
一.定义 1.pH pH=–log[H] pH是衡量溶液整体酸碱度的指标,具体指溶...
溶解度(Solubility)与溶度积常数(Solubility Product Constant, ksp密切...
【导读】与第一电离能定义相反(并非严格互逆过程),第一电子...