
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
CO32-与Mn+在水溶液中的水解反应式为:
CO32- +H2O  HCO3- +OH-
HCO3- +OH-
Mn++H2O [M(OH)](n-1)++H+
[M(OH)](n-1)++H+
当将CO32-与M2+两种溶液混和,可能存在如下多重平衡:
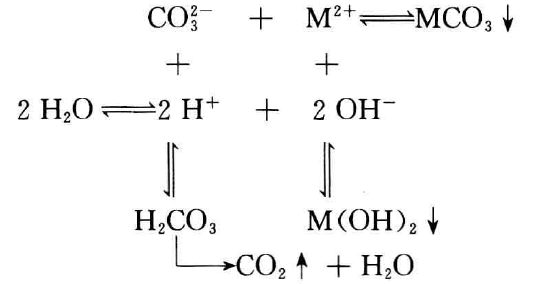
MCO3+M(OH)2  M2(OH)2CO3
M2(OH)2CO3
根据MCO3、M(OH)2的溶解度不同,可得三种不同的产物。
(1) 生成碳酸盐。若金属离子不水解,如Ba2+、Ca2+、Sr2+等即生成此类盐。
Ca2++CO32-=CaCO3
(2) 生成碱式碳酸盐。如金属离子水解,M(OH)n的溶解度与M(CO3)n/2的溶解度相差不大,像Mg2+、Fe2+、Cu2+、Zn2+、 Ag+、Mn2+、Pb2+等即生成此盐。
4 Ag+ + 2 CO32- +H2O=Ag4(OH)2CO3 +CO2
2 Cu2++ 2 CO32-+H2O=Cu2(OH)2CO3 +CO2
(3) 生M(OH)n。若Mn+极易水解,同时M(OH)n的溶解度比 M(CO3)n/2的小得多,如Fe3+、Cr3+、Al3+等生成氢氧化物。
2 Fe3++3 CO32-+3 H2O  2 Fe(OH)3 +3 CO2
2 Fe(OH)3 +3 CO2
因为金属离子的水解性与M(OH)n碱性成反比,即Mn+越 易水解M(OH)n的碱性越弱。
由此上述反应规律可总结为:其氢氧化物碱性较强的金属离子可沉淀为碳酸盐;氢氧化物碱性较弱的金属离子可沉淀为碱式碳酸盐;而强水解性的金属离子则以氢氧化物形式沉淀。
据此,可溶性的Na2CO3或(NH4)2CO3常用作金属离子的沉淀剂。
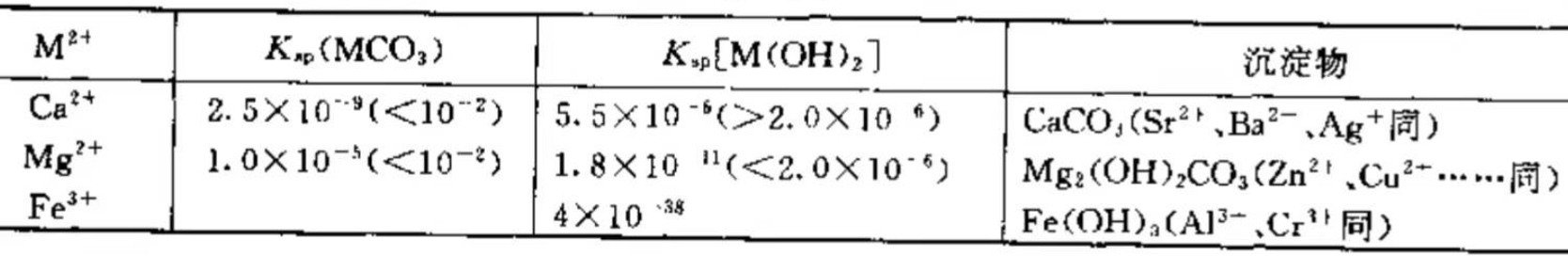

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。【导读】与第一电离能定义相反(并非严格互逆过程),第一电子亲和能是指基态的气态原子...
【导读】 根据 质子酸碱 理论: 酸是 质子的给予体 , 给出质子 (H ) 的物质 ; 碱是 ...
电离概念是中学一个基本概念,用以区分电解质和非电解质、共价化合物和离子化合物。其...
1. 如何理解 “ 水解 ” 反应的概念? “ 水解 ” ,顾名思义,可理解为 “ 某物质遇...
为什么NaHCO 3 溶液能与Na[Al(OH) 4 ]溶液反应? NaHSO 3 溶液之所以能与Na[Al(OH) 4 ...
双水解程度计算: 同样是双水解,为什么CH 3 COO - 和 NH 4 + 可以大量共存,而Al 3...