
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
化学反应平衡常数是一个重要的化学基本概念。通常人们都认为,从平衡常数的大小可以估计反应的可能性,判断出反应进行的限度。因为对可逆反应来说,平衡状态是反应进行的最大限度[1]。
至于反应进行“最大限度”的含义,究竟是什么呢?一般将其理解为,就是某反应物的平衡转化率。因为平衡转化率越大,表明该物质理论上能被反应掉的量就越多。反之,就是反应物剩余的还不少。
但是,并不是所有反应进行的限度,都可以用转化率来表示。为了能真正理解这个问题,最好就其平衡关系式的不同形式,对平衡常数来进行一个分类。
一、平衡关系式为较复杂的分式
在引入平衡常数概念时,一般都是就这种最为常见的水溶液中的可逆反应:
aA+bB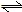
而给出其平衡常数K的平衡关系式为,
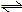 。
。
如果上反应方程式中各物质都是气体,则有,
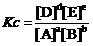 。
。
不难看出,这样的平衡关系式,都是由多个物质浓度项方次、或分压项方次、共同构成的一个数学意义上的分式。这个分式不但有分母项和分子项,并且还要涉及多余两个的物种。
这个式子集中地体现出了可逆反应的特点。即,理论上,这个关系式中的哪一项都不会等于“0”。
也就是说,哪怕平衡常数Kc极大、反应进行的再完全,反应物[A]与[B]也不会是“0”,反应物一定会有“剩余”(尽管可能是极少)。因为当[A]与[B]趋近于零时,这个分数的数值(也就是浓度商)就会是无穷大,会比任何Kc都更大。这就会导致该反应逆向进行,使[A]与[B]能满足平衡状态。
反之,如果平衡常数Kc极小,反应再难进行,反应产物[D]与[E]也不会是“0”,总会有一些反应产物“生成”(哪怕是极少)。因为当[D]与[E]为零时,整个分数的数值就会是“0”(会比任何Kc都小),这会使反应正向进行,并达到平衡状态。
总之,这样的反应从本质上看,都是可逆反应。其进行的程度,只有用转化率才能进行精准的描述。
在以前无机化学教材中所给出的说法,当Kc>106时,正反应能进行完全;而Kc<10-6,则意味着正反应完全不能进行。就是针对上反应中a=b=d=e=1,且各反应物浓度都相等时,A与B的理论转化率为99.9%,及转化率为0.1%,而分别设定的(在制备反应中能有这样的转化率,当然是可以被接受的)。
对任意的这类反应,在知道反应物A与B初始浓度的具体数值时,通过其平衡关系式,学生都可以计算出方程式中各物质的平衡浓度、及A或B的转化率。这种计算方法已是中学化学的教学内容。
对于这类反应来说,“反应进行限度”只能用转化率来体现。
二、平衡关系式为简单分式
所谓的简单分式,就是平衡关系式的分子和分母,都只有一个物质的浓度项。
如,对于BaSO4与Na2CO3溶液间的沉淀转化反应,
BaSO4+CO32-=BaCO3+SO42-。
其平衡关系式(固体物质不得写入),及平衡常数的数值为,
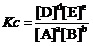 ……(1)
……(1)
这就是一个,分式中的分母与分子,都只有一个物质浓度项的平衡关系式。它是一个相当简单的浓度比值。
用这类平衡常数来计算某反应物的转化率时,有两种可能的情况。
1.可以直接读出某物质的转化率
当各物种仍共存在平衡体系中时,平衡常数所关系到的物质的转化率,是不需要另行计算的。可以从平衡常数直接读出。
如,从上述平衡关系式(1)及其平衡常数的数值,人们一眼就可以看出,在达平衡状态时,溶液中的[SO42-]只能是[ CO32-]的1.3%。也就是NA2CO3的转化率是1.3%。
这个数据的实用意义是,难溶物BaSO4在Na2CO3溶液中可以被部分地“溶解”。虽然BaSO4在这里溶解的并不多,但如果它出现在提纯实验中,那就应该极力避免了。
比如,在精制NaCl时,先用BaCl2沉淀完其中的SO42-离子后。如果不将BaSO4沉淀过滤掉,就接着往这个悬浊液中加Na2CO3(沉淀Ca2+离子的试剂),那就会造成BaSO4的重新溶解。
因为,当沉淀试剂Na2CO3在溶液中的浓度哪怕只达0.01mol•L-1(它必须要过量),原本已成沉淀的BaSO4就要因发生沉淀转换反应而重新溶解。且根据平衡常数的比值限制,溶液中[SO42-]必须回升到1.3×10-4mol•L-1(0.01mol•L-1的1.3%),而大于“1.0×10-5mol•L-1”(杂质离子的去除标准),使沉淀SO42-离子的工作前功尽弃。
这时,只要还知道体系中BaSO4沉淀的总量,Na2CO3溶液的体积,当然还可以计算出BaSO4沉淀在这个转化反应中的转化率。
2.没有达到最大转化率的情况
当某反应体系因反应物起始量的关系(不成比例),无法达到平衡状态。那就用不着平衡常数,只根据方程式就可以计算出某物质的转化率。
还是用粗盐提纯为例。如果原溶液中起始的[SO42-]就没有达到1.3×10-4mol•L-1。那么这些被沉淀出来的BaSO4沉淀,在加入上述浓度Na2CO3溶液时,就会全部再回归到溶液中去。
当然,在这样情况下,BaSO4沉淀的转化会是完全的,其转化率为100%。针对这个体系来计算Na2CO3的转化率,也不会再涉及平衡常数。
还可以举一个类似的例子。
那就是锌片与亚铁盐溶液间进行的置换反应。方程式为“Zn+Fe2+=Fe+Zn2+”。其平衡关系式为,
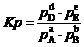 。
。
它形式上还是一个离子浓度的比值。
它虽然是一个较大的值。但是它反映的也是,只要溶液中的[Zn2+]增加、与[ Fe2+]减少至上述比值,当Zn还有剩余时,这个置换反应也不会继续进行下去了。这时,Fe2+离子的转化率就是C(最好将其改写为百分数)。
如果,Fe2+离子过量、而Zn没有剩余,那就不需平衡常数,用方程式就可以计算出结果。
总之,对于这类反应,平衡常数对于反应限度的描述,主要指的是这个更直观的离子浓度比值。
这是“反应进行限度”的又一层含义。
三、平衡关系式为离子浓度乘积
所谓平衡常数关系式为离子浓度乘积,就是有如K=[D]d[E]e,这样的形式的平衡常数。
它对应的化学方程式当然是,DdEe(s)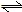
该平衡常数没有分母项(也可认为分母项为“1”),或者分子项为“1”(上一过程逆反应的平衡关系式)。
这个平衡常数描述的可以是某难溶电解质的溶度积,也可以是某可溶电解质的溶解性,还可以是一个化学反应。
这类过程也可能是进行完全的。此时,这就是一个不需要用平衡常数来讨论的过程。
比如,在很大量的溶剂水中,加入很少量的CaSO4固体。当这些CaSO4不足以去形成一个饱和溶液时(CaSO4无剩余),就无法用平衡常数对这个过程进行描述。
而在CaSO4固体与其溶液共存的情况下,用其溶度积就可以计算出,这个溶液中[Ca2+]及[SO42-]的具体数值。
要注意的是,这类过程的平衡常数的数值,很少会是一个比“1”(这相当于该反应的ΔrGo=0)大的数值。
因为现实中的物质,其溶解度能达到10g/100g H2O,就属于易溶物质的范畴了。如果该物质的摩尔质量为100,那么其饱和溶液的浓度就近似于1 mol•L-1。而这就相当于,其K=[D]d[E]e=1。
即便某物质溶解过程的K=[D]d[E]e<1(相当于该反应的ΔrGo>0)。它也不见得就是难溶的物质。
不难计算出来,如果某将AB型溶质的摩尔质量按100来估算,即便是K=0.1,其溶解度也相当于3 g/100g H2O,属于“可溶”物质;即便是K=1.0×10-6,其溶解度也相当于0.01 g/100g H2O,属于“微溶”物质的范畴。
还要注意的是,个别化学反应的平衡关系式,也表现为离子浓度乘积。
如,在近两年的一道高考题中就出现了反应,Cu+Cu2++2Cl-=2CuCl。其平衡关系式为,
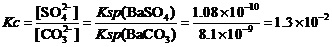 。
。
本质上也就是
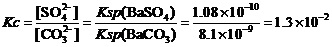 。
。
如果学生考前没有接触过这类平衡关系式的话,解题会有较大难度。
总之,对于这类反应,平衡常数对于反应限度的描述,主要指的是这个“离子浓度”的乘积。这是“反应进行限度”的又一层含义。
四、平衡关系式仅为某物质分压
有一类反应的平衡关系式,从涉及的物种数来看,是无法再简单的了。
它针对的是如下这些反应,
反应一、CaCO3(s)=CaO(s)+CO2(g),Kp=p(CO2)。
反应二、CuSO4• 5H2O(s)= CuSO4• 3H2O(s)+ H2O(g),Kp=p2(H2O)=1.05×10-4(298K时)
这些平衡关系式中都只有一个气体物质的分压项。
即便是对于反应二,实际上告诉人们的也是,
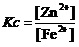 。
。
很明显,这种平衡关系式对反应限度的描述,靠的就是一个所涉及的气体分压。这是一个真实的物质性质函数数值。
比如,对于反应二的p(H2O)=1.02×10-2(atm)。它指的就是室温下CuSO4• 5H2O与CuSO4•3H2O能保持平衡状态的水蒸气压。
当其所处体系中的p(H2O)大于1.02×10-2(atm)时,CuSO4•3H2O就会吸水,而变成CuSO4• 5H2O。反之,当体系中的p(H2O)小于1.02×10-2(atm)时,CuSO4•5H2O就会从其晶体表面上失去结晶水(即风化),而变成CuSO4• 3H2O。
由于这些反应都是吸热反应,随着温度的上升,其平衡常数都要变大。从一些热力学函数可以计算出,当温度为374K时,反应二将会有,平衡常数Kp=1,也就是平衡p(H2O)=1.0 atm。
在无机化学中之所以要计算出这个Kp=1的温度值,是因为这是一个相当于液态水“沸点”的一个关键数值。
只不过对反应二来说,374K是反应形式的突变点。而水的沸点是个相变点。
因为,在低于374K这个温度时,反应二还只能是在晶体表面上缓慢进行(此时产生的水气分压也会小于1.0 atm)。而在略高于这个温度时,反应二就会在整个晶体内部,剧烈地进行(产生的水气分压也要大于1.0 atm)。
当然,由于热传递的原因,晶体的温度要从外到里逐渐升高、并先后达到374K,所以这个分解反应实际上还是在晶体中逐层来进行着的。
另一方面还要知道的是,体系的分压还要受气体物质的量及体积的影响(遵循PV=nRT)。所以,受反应所处环境影响,变化的情况也比较复杂:
如果它是一个开放的、能保持374K的系统,分解反应放出的水气还可以及时地逸出。那么反应也就会一直进行下去,直至CuSO4• 5H2O都变成CuSO4• 3H2O。
在石灰窑中也是这样(只不过其分解温度要高得多)。随着CO2不断逸出,石灰石会完全变成生石灰,其转化率可为100%。
如果是在一个密闭且体积不变的系统中反应,在374K下,由于水气无法逸出,当体系中的P (H2O)达到1.0 atm后,分解反应就不会继续进行下去了(已达平衡)。
如果打算用升高温度(T2)的方法,使反应继续进行(高温下平衡常数Kp2会更大、p2(H2O)也会更大)。那么升温反应至水气的平衡分压为p2(H2O)时,反应还会因已达平衡状态而再次终止进行。
对于这类反应来说,平衡常数直接关联的就是体系中某气体的分压,它是一个绝对量。仅根据这一个量,就可以判断反应的进行方向、及反应的形式(表面、还是整体)。这应该是“反应进行限度”的另外一个含义。
至于其“转化率”,那就完全取决于反应的条件,也就是某一物质的分压是否能保持住。
五、复合平衡常数的平衡关系式
通常把平衡关系式中既有浓度项,又有分压项的平衡常数,称之为复合平衡常数。
如,对应于H2S气体制取的反应,FeS+2H+=Fe2++H2S。其平衡常数关系式为,
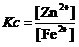 。
。
这就是一个复合平衡常数。也是相对更复杂一些的平衡常数。
当然,它对“反应进行限度”的表达方式也会更复杂一些,也就是还与反应的条件有关。
可以分为如下的几种表现情况来讨论,这个“反应进行限度”的含义。
第一种,实验室中制备H2S的情况(用启普发生器)
此时,可以认为有p(H2S)=1.0 atm。这样,平衡常数就成为了一个浓度比。
只要启普发生器中的物质浓度比低于这个值,正反应就可以不断地进行。
直至浓度比达到这个值,体系就处于平衡状态。此时,它也就不再具备有制备H2S的能力。
第二种,在开放体系中进行的该反应
当所产生出来的H2S能够随意地逸出时(相当于把启普发生器中所有反应物都倒入一个大烧杯)。由于环境中的H2S气体分压会无限趋近于“零”,所以这个反应的彻底性就表现为。两种反应物中,必须要有一个的剩余量为“零”。或者是FeS为“零”(其转化率为100%),或者是酸为“零”(其转化率为100%)。当然,还可以是两者同时为“零”。
第三种,只有固液两相存在的情况
当H2S气体只能溶于溶液中,体系不允许有气态物质存在时(当然这会比较难于实现,反应容器要足够地“耐压”)。那就只能用浓度平衡常数Kc来讨论这个问题。
要注意的是,这个K与Kc间的换算,不能再用PV=nRT。因为用理想气体状态方程计算出来的仍是H2S在气相中的浓度,还是与这个体系无关。
这时要考虑的是H2S的溶解度S。当H2S的溶解度用“mol•L-1”为单位时,有关系式p(H2S)•S=[H2S]。用它就可以计算出该反应的Kc。
用这个Kc,在已知各反应物起始量的情况下,就可以计算出各物质的平衡浓度、及各物质的转化率。也就是,Kc与转化率有关。
可见,对于复合反应平衡常数来说,其对“反应进行限度”的描述,会有更多的角度。
总之,从上面的讨论可知:平衡常数对“反应进行限度”的表达方式是多种多样的,它与反应的形式有关,与反应的条件有关。对不同形式及条件的化学反应来说,它可能是转化率,也可能是某两个浓度项(或分压项)的比值,也可能是某两个浓度项(或分压项)的乘积,还可能是某一气体的分压(这是一个绝对量,而不再是相对量)。
不清楚平衡关系式可能出现的各种形式,也就不会真正理解“反应进行限度”的丰富含义。
参考文献
[1]北京师范大学等校.无机化学(第三版).高等教育出版社. 1992年

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
在化学反应中,驱动力指的是推动反应进行的内在因素,它决定...
一.核心概念辨析 中间体:寿命长于分子振动的瞬态物种,多步...
活化分子百分数和活化分子数,理解它对掌握化学反应速率至关...
化学反应的焓变越大,代表这个反应受温度变化的影响越大吗?...
在化学热力学和分析化学中,我们常常听到这样的说法:“如果...
...