
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
根据分子组成来判断分子中是否有大Π键,有什么类型的大Π键,是否有d-pπ键,这些问题一直都是无机化学教学中的难点。
一、大Π键与π键的关系
(一)离域π键的概念
把分子轨道理论的一些结果,引入价键理论,来解释分子的结构和一些性质,产生了离域π键的概念。
离域π键不同于两原子间的π键,是由三个或三个以上原子形成的π键。不像普通π键,它的成键电子不再局限在两个原子之间的区域,而是在多个原子之间运动,从而把这多个原子键合起来。所以也叫大Π键,或多原子π键。
一般生成离域π键的体系,其能量都比按对应的经典定域键结构式所估计的要低。这个降低的数值称为离域能。
通常认为,某分子或离子要同时满足下列3个条件,其中才能形成大Π键:
(1)有3个或3个以上的原子在同一平面;
(2)都有垂直于这一平面的p轨道;
(3)成大Π键的电子数小于轨道数的2倍。
大Π键按成键的P轨道数目、或说原子数(每个原子对该键也只能提供1个p轨道),及成键的电子数来彼此区分:Π34表示有3个p轨道、4个价电子,Π46表示有4个p轨道、6个价电子,Π66表示有6个p轨道、6个价电子……。
现就一些分子中的大Π键的成键情况,用分解轨道和电子数(如用pz1表示这个p轨道沿z轴伸展、且只有1个电子、读为有1个电子的pz轨道。用(sp)1表示1个sp杂化轨道上有1个电子,读为有1个电子的sp轨道)的方法,分析如下:
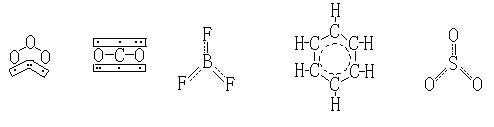
在O3分子中,中心O原子为平面三角形的sp2杂化,它有3个sp2杂化轨道、1个未参与杂化的pz轨道、6个价电子。中心O原子的电子分布情况为:(sp2)1、(sp2)1(分别与2个O原子沿配原子的px方向成σ键)、(sp2)2(被孤电子对占据)、pz2(用于成π键或大Π键)。每个配O原子的2个成单电子都是px1(用于与中心原子成σ键),及pz1。中心O原子的pz2与另2个O配原子的pz1满足相互重叠的条件,成折线型的Π34键。如左下图及表所示。
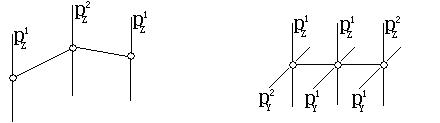
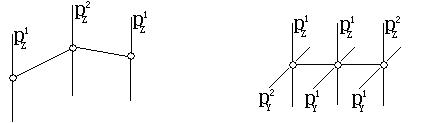
在CO2分子中,中心C原子为直线形的sp杂化。中心C除用2个sp杂化轨道分别与另2个配位O原子成σ键外,中心C原子还有2个分别有1个电子的未杂化的相互垂直的py1和pz1。中心C原子可用一个py1与另2个O原子的py1的py2,成1个(Πy)34键;用另一个pz1与另2个O原子的pz2的pz1,成另1个(Πz)34键。即,在CO2分子中有2个直线型的Π34键。如上右图及表。
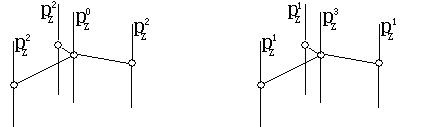
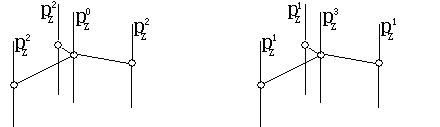
如左下图,在BF3分子中,B为sp2杂化。B除用3个sp2杂化轨道与3个F原子成σ键外,B原子还有1个pz0(空的、无电子)。B原子可用该pz0,与3个F的pz2(均已有1对电子),成Π46键。

对C6H6分子,每个C原子都是sp2杂化的。C原子除用1个sp2杂化轨道与1个H原子成σ键外,还用2个sp2杂化轨道与相邻2个C原子相互成σ键,构成一个六元环。C原子还有1个pz1轨道(有1个电子)。6个C原子能用其6个pz1轨道可以形成1个环状的Π66键。
如上右图,在SO3分子中,中心S原子为sp2杂化。中心S除用3个sp2杂化轨道分别与另3个配位O原子成σ键外,中心S原子还有1个剩有3个电子的未杂化的pz3。中心S原子可用其pz3与另3个O原子的pz1成1个Π46键。当然在这个例子中,学生自然对pz3的表示方法会有一些质疑,1个p轨道怎么能容纳3个电子呢?我们只好再解释为,这个数字实际是该原子对大Π键应贡献的电子总数。
可见,在讨论是否形成大Π键时,关键在于有多少个垂直于同一平面的p轨道,以及各原子向大Π键贡献的电子总数是否不是太多(要少于轨道数的2倍)。与每个原子提供了多少个电子基本无关。
(二)含有大Π键分子的表示方法
含有大Π键分子也可以与其它分子一样写出结构式。
对上述的有1个折线型Π34键的O3分子、有2个直线型Π34键的CO2分子、有Π46键的BF3分子、有Π66键的C6H6分子、有Π46键的SO3分子,其结构式分别为:

结构式是在用横线(—)标出σ键的基础上,再把Π34键用方框、把Π46键和Π66键用虚线表示出来。
对O3和CO2还可以写出电子式。即在写出路易斯电子式的基础上,把参与构成某个大Π键的各原子的价电子,用框与其它电子区分开来。其电子式分别为:
可见,分子中只有1个Π34键时(有1个方框),无论分子结构是写为角型、还是写为直线型,分子实际都是折线型的。当分子中有2个方框时,重原子有直线的构型。
Π46键分布于一个平面上,中心原子在该平面中间,不宜用平面的电子式来表示。
(三)大Π键的与π键的关系
其实,比较一下Π34键、Π46键及Π66键等例,不难看出,它们都可以被认为是由π键再与相邻原子的1个、2个p孤电子对、或1个、2个相邻的π键,形成的再“肩并肩”组合。
把这些组合因子用符号表示:π键写为π22的形式,表示它有2个p轨道、2个价电子;p2表示有孤电子对的p轨道;p1表示有1个成单电子的p轨道。不难得出:
1个π22与1个p2相邻,会构成1个Π34键(如SO2分子中);
1个π22与2个p2相邻,会构成1个Π46键(如SO3分子中);
1个π22与1个p1相邻,会构成1个Π33键(如NO2分子中);
1个π22与1个π22相邻,会构成1个Π44键(如丁二烯分子中);
1个π22与2个π22相邻,会构成1个Π66键(如苯分子中)。
可以认为以上几种形式的大Π键都是在普通π键的基础上,由π键与其相邻键合原子的P轨道或π键再重叠,而构成的。
这样,对非过渡系ABm型分子来说,可以很容易地断定在两种情况下分子中一定没有大Π键。一是,当分子只有2个重原子时;另一个是,当中心原子为sp3、sp3d、sp3d2、sp3d3杂化时。前者是缺少可以再重叠的P轨道,后者则是其中根本就无π键。
当中心原子为sp2杂化时,分子中一定有1个π键,并有可能用其组成1个大Π键;当中心原子为sp杂化时,分子中一定有2个π键,并有可能用其组成2个大Π键。
二、判断分子中的大Π键
把大Π键的形成条件当做判断方法,实际使用起来有时比较麻烦的。我们总不能不怕做无用功,对每个分子都用这3个条件验算一番吧。
综上讨论,应该采用如下方法来判断分子中大Π键的有无和种类:
(一)
对有3个以上重原子的分子,先用总配位数式确定中心原子杂化类型。只有当中心原子为sp2和sp杂化时,才可能形成大Π键,才有必要继续进行下面的讨论。
第一步,考察配原子种类和个数。当有2或3个端基的F或O或N当配原子时,分子中一定有大Π键(这些原子也都有合适的p轨道)。端基F或O或N原子的个数加1,就是成键原子数。注意,非端基的O或N(如-OH、-NH2为sp3杂化,无未杂化的p轨道,不可能与中心原子成大Π键;而(=NH)为sp2杂化,有1个未杂化的p轨道,可与中心原子成1个大Π键。
第二步,计算成键电子数。
当中心原子为sp2杂化时,中心原子与每个配原子结合都要用1个电子,如有1个未键合的sp2杂化轨道还要占用1对孤电子对,所余下的就是它向大Π键提供的电子数。配原子则按F提供2个电子、O和N都提供1个电子来计算。这些电子之和就是参与大Π键的电子数。
当中心原子为sp杂化时,中心原子可能参与2个大Π键的形成。中心原子除用2个电子与配原子成σ键外,其余电子要尽可能均匀地分配给py和pz轨道,在轨道py和pz上标出所分得的电子数。端基配原子则按F提供py2和pz2电子、O提供py1和pz2电子、N提供py1和pz1电子来计算。把py和pz电子分别相加就是相应大Π键所包含的电子数。注意:两大Π键成键电子数相差大时,应把O的p轨道上的电子数对调,即把py1和pz2改为py2和pz1)。
第三步,写出大Π键的符号。按要求写出分子的结构式或电子式。
具体使用情况与上面的成键过程讨论相同。
(二)由电子式来判断
在写出正确的电子式或结构式的基础上,也比较容易判断出一般分子中是否有大Π键。
第一步,写出电子式。由此判断每个原子的杂化类型(其所属的电子对及电子组总数),及分子中π键的个数及位置。
第二步,逐个π键的考察,该π键所键合的两个原子。
当这两个原子还键合有其它端基的F、O时(有与π键平行的p轨道),则它们一定会与该π键组合成大Π键。当配原子P轨道都是孤电子对时,可用π22+ up2= Π2+u2+2u的算式确定大Π键的类型(u为端基F、O的原子数)。
当这两个原子所键合的另一原子上有另一个π键时,则它们一定会相互组合成大Π键。可用uπ22= Π2u2u的算式确定大Π键的类型(u为可相互重叠的π键数)。
对初学者来说,在小π键基础上再考虑大Π键的构成,遇到的困难要少一些。当然也使他们能更清楚了π键与大Π键的关系,避免了大Π键漏算或与π键的重复计算。
如对SO2分子,路易斯电子式如左下。可看出S为sp2杂化(它有3个电子对及电子组),S与其左侧的O原子间有1个σ键和1个π键。S原子与右侧的非羟基O配原子以σ配键结合,该O配原子能以p2与S原子左侧的π键成Π34键(π22与p2组合)。
对丁二烯CH2=CH-CH=CH2,从结构式即可看出,其中的4个C原子都是sp2杂化,左侧2个C原子和右侧2个C原子间各有1个π键。这2个π键还是以1个σ键紧紧相连的,所以可以再组合成1个Π44键(π22与π22组合)。
三、d-pπ键
为说明含氧酸的性质,有的学校把d-pπ键也引入了无机化学或普通化学的教学。
(一)d-pπ键的生成
当中心原子为sp3杂化时,中心原子与配原子间有可能形成d-pπ键,或称为dπ-pπ键。d-pπ键是由配原子的p轨道与中心原子的合适d轨道相互重叠而生成的,是第三周期及以下周期原子的d轨道参与成键的一种形式。
它是由中心原子的dx2-y2轨道,与1个或几个配原子的py轨道彼此重叠,及中心原子的dz2轨道,与1个或几个配原子的pz轨道彼此重叠,而生成的有多原子参与、电子不局限于两原子之间的化学键。它也具有离域键的性质。
将SO42-的sp3杂化轨道放在一个立方体中,比较容易看出配原子O的p轨道与中心原子S的d轨道相互重叠的情况:
左下图为中心原子S的dx2-y2空轨道,与1个配原子O的已有2个电子的py2轨道的相互位置图,可以看出当再相互靠近时,两轨道可以较好地重叠,另外3个O原子与这个O原子相似,也有py2轨道,只是为不使画面太乱而没有画出。
右下图为心原子S的dz2空轨道,与1个配原子O的已有2个电子的pz2轨道的相互位置图,可以看出如再相互靠近时,两轨道可以较好地重叠,
如SO42-的中心原子S与4个配原子O之间除分别有1个σ键外,还要共同构成2个如上的d-pπ键。成键的轨道及电子数可以用如下的方法计算:假设中心原子S单方面提供4对电子(原有6个价电子、加上由所带负电荷赋予的2个电子)与4个配原子O之间形成4个σ配键,这样S原子的dx2-y2轨道与dz2轨道就都是空的了。而每个O配原子的py2轨道与pz2轨道都各有1孤电子对。所以这2个d-pπ键中的每一个都是由5个轨道(S原子的1个d轨道、每个O原子的1个p轨道)和8个电子(每个O原子提供1对p电子)构成的。
对H2SO4来说情况则有所不同。S原子连接有2个羟基与2个非羟基氧。羟基氧与中心原子S一样,也是sp3杂化,这样羟基氧无未杂化的p轨道,无法参与d-pπ键的形成。S原子与每个羟基的O要各出1个电子形成有1个σ键,还余4个电子与2个非羟基氧结合,其中包括2个如上的d-pπ键。成键的轨道及电子数应计算为:假设中心原子S单方面提供2对电子(原有6个价电子中有2个电子与羟基氧结合)与2个配原子O之间形成2个σ配键,这样S原子的dx2-y2轨道与dz2轨道就都是空的了。而每个非羟基O原子的py轨道与pz轨道都各有1孤电子对。所以这2个d-pπ键中的每一个都是由3个轨道(S原子的1个d轨道、每个非羟基O原子的1个p轨道)和4个电子(每个非羟基O原子各提供1对p电子)构成的。平均算起来,在H2SO4分子中,每个非羟基氧与中心原子S之间还真是双键结合。

由于影响d-pπ键有效性的因素较多。如与中心原子杂化轨道的不等性程度有关,与中心原子及配原子的半径有关。所以对不同的d-pπ键来说,它的有效性也可能在0和2之间变化。从而使中心原子及配原子间的化学键的键级能在叁键和单间之间波动。
(二)d-pπ键的判断
d-pπ键的形成条件:中心原子要为sp3杂化、同时有能量低的空d轨道,配原子要有成对的p电子。
这3条也可以看作是d-pπ键的判别标准。只是要注意:中心原子要为sp3杂化应认真判定,不能只看分子式;当中心原子是第二周期的元素时、是无能量低的空D轨道的;当配原子为端基的F、O(非羟基)时,它有成对的P电子,而H、-OH为配体时是不能提供成对的P电子的。
对判断的方法举例如下:
SF4的中心原子实际为sp3d杂化,不可能成上述的d-pπ键。
CH4的中心原子C为第2周期元素,无能量低的d轨道;配原子H无p电子。后两个条件都不满足,不可能成d-pπ键。
SiH4的配原子H无p电子。不满足最后一个条件,也不可能成d-pπ键。
CCl4的配原子Cl虽有p电子。但C无d轨道,不满足中间的条件,不可能成d-pπ键。
H4SiO4的配体为-OH,羟基氧为sp3杂化,无成对的p电子,不可能成d-pπ键。
而SiCl4、SO42-,中心原子为sp3杂化,有空的d轨道,配原子也有成对的p电子。3个条件都能得到满足,其中都有d-pπ键。
参考文献:
[1]北京师范大学无机化学教研室等编.无机化学(第三版).北京:高等教育出版社. 1992
[2]

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
一般来说,同主族元素形成的R-R键键能从上至下,键长逐渐增大...
离子极化与影响元素 离子极化理论是离子键理论的重要补充。...
原子之间形成共价键时,若共用电子对只是由一方原子提供电子...
p区元素化学的学习中我们常常发现,很多非金属含氧酸的游离酸...
不是的。 只能提供一对孤对电子与中心原子形成配位键,被称为...
磷的含氧酸共有四种: 磷酸(H 3 PO 4 ),结构式 :三元中强酸...