
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!

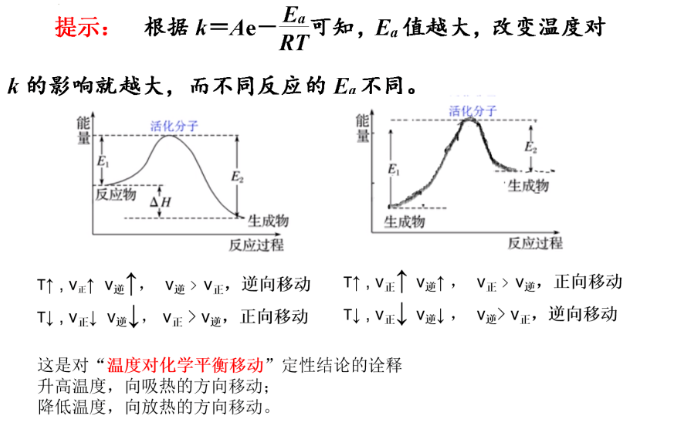

本题考查了阿伦尼乌斯公式中温度和速率常数的关系,即温度升高,速率常数变大。
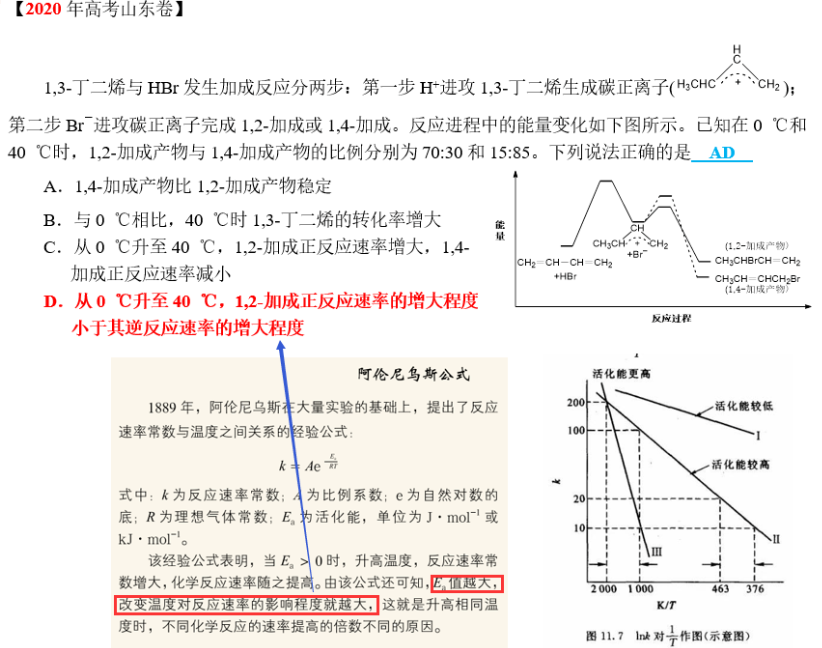
本题考查了阿伦尼乌斯公式中活化能大小决定了温度对速率影响程度的关系,即活化能越大,温度对反应速率的影响程度越大。
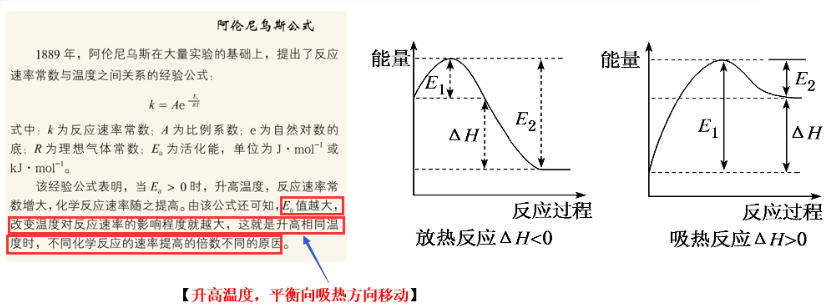
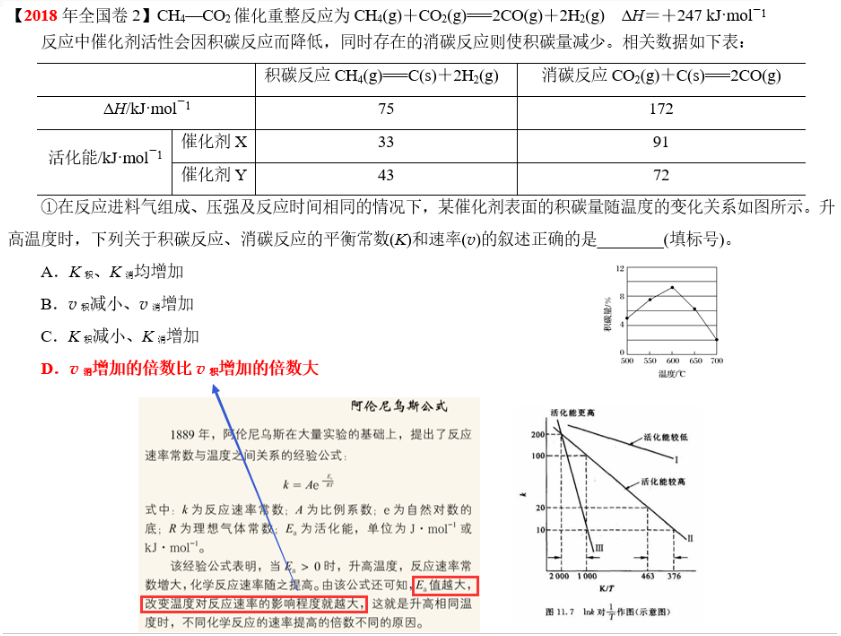
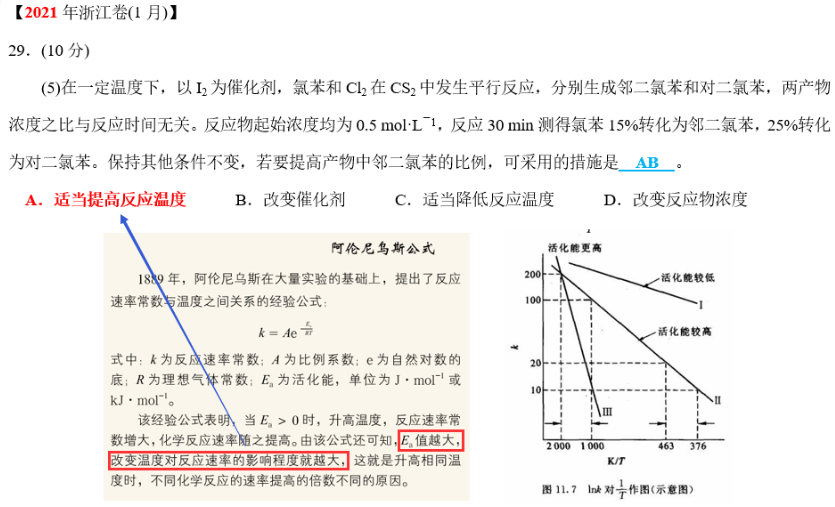
本题依据平行反应活化能的不同,通过调控温度来不同程度改变平行反应的速率,以及利用催化剂的选择性以提高合邻二氯苯的比例。
小结:在以上高考题中,应用阿伦尼乌斯公式解释了温度与速率的关系以及利用温度与速率的关系进行生产条件的调控:
(1)温度升高,速率常数增大;
(2)温度对活化能大的反应速率的影响程度要大,所以升高温度,平衡向吸热反应的方向移动;
(3)利用温度对活化能不同的反应速率影响程度不同,通过调控温度来提高目标产品的选择性。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。在化学热力学与工业生产的交叉领域,范特霍夫方程将平衡常数与温度的抽象关系转化为可...
在化学平衡的学习中,压强对气体平衡的影响与水溶液中“越稀越电离、越稀越水解”的规...
在化学动力学研究中,基元反应是理解反应机理的 “最小单元”,而反应速率方程则是描...
在多重平衡体系中,各物质在达到平衡状态时的浓度。多重平衡体系是指一个化学反应体系...
催化反应的核心始于吸附机理——分子通过物理吸附(范德华力)或化学吸附(化学键重组...
武汉市九月调考试题 解析 一般来说,有几个 过渡态就有几个基元反应。 那么吸附或脱附...