
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、范特霍夫方程:化学反应的“平衡指挥家”
在可逆反应里,化学平衡常数(K)能衡量反应进行的程度。K越大,意味着反应正向进行得越彻底。范特霍夫方程就揭示了K和温度(T)之间的关系,它的核心就是:平衡常数随温度的变化,取决于反应是吸热还是放热。


二、阿伦尼乌斯公式:化学反应的“速度助推器”
阿伦尼乌斯公式描述了化学反应速率常数(k)和温度(T)的关系。它能帮助我们了解反应速率在不同温度下是怎么变化的。

☆阿伦尼乌斯公式:
“升温必加速,k随T增而增”(因为Eₐ恒正,升温一定让反应更快)。
☆范特霍夫方程:
“吸热升K,放热降K”(K的变化由ΔH决定,和吸放热方向一致)。
三、实例解析:以合成氨反应为例
合成氨反应是工业上应用两个公式的经典案例,反应式为:
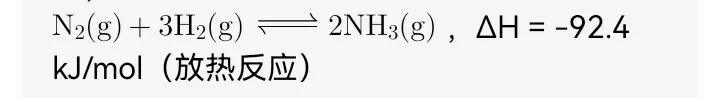
1. 范特霍夫方程的应用:温度对平衡产率的影响
- 由于反应放热(ΔH<0),根据范特霍夫方程,升温会使平衡常数K减小。
例如:温度从25℃升至500℃时,K值从6.8×10⁵骤降至1.5×10⁻⁵,意味着高温下氨的产率极低。
因此,从平衡角度看,低温更有利于氨的生成。
2. 阿伦尼乌斯公式的应用:温度对反应速率的影响
- 反应的活化能Eₐ为正(约335 kJ/mol),根据阿伦尼乌斯公式,升温会使速率常数k增大,反应加快。
例如:常温下反应速率极慢(k值很小),即使K很大,也难以实际生产;升温至400℃时,k值大幅增加,反应速率提升数万倍。
因此,从速率角度看,高温更有利于反应快速进行。
3. 工业条件的折中:兼顾限度与速率
实际生产中,需同时考虑两个公式的结论:
- 若温度过低(如25℃),虽K很大,但k极小,反应几乎不发生;
- 若温度过高(如600℃),虽k很大,但K极小,产率过低。
最终选择400~500℃,并使用催化剂(降低Eₐ,进一步加快速率),在产率和速率间找到平衡。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。在化学平衡的学习中,压强对气体平衡的影响与水溶液中“越稀越电离、越稀越水解”的规...
在化学动力学研究中,基元反应是理解反应机理的 “最小单元”,而反应速率方程则是描...
在多重平衡体系中,各物质在达到平衡状态时的浓度。多重平衡体系是指一个化学反应体系...
催化反应的核心始于吸附机理——分子通过物理吸附(范德华力)或化学吸附(化学键重组...
武汉市九月调考试题 解析 一般来说,有几个 过渡态就有几个基元反应。 那么吸附或脱附...
在化学热力学中,吉布斯自由能变(ΔG)是判断反应自发性的核心判据,其核心规律 “Δ...