
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
在学习《活化能》时,有学生注意到“反应进程—势能图”与学习《反应热》时的“反应进程—势能图”几乎一模一样:
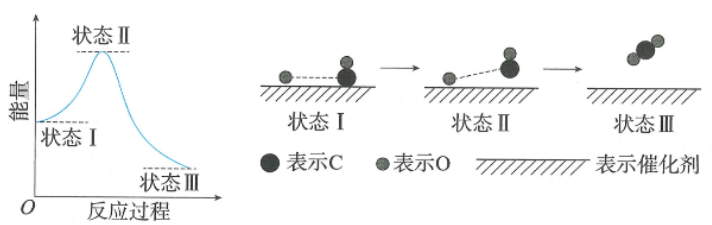
便提出疑问:正反应的活化能和反应物的总键能等同吗?
这是一个非常好的问题,也是化学动力学中一个常见的困惑点。
简短的回答是:不,正反应的活化能和反应物的总键能绝对不等同。 它们是两个完全不同的概念,描述了化学反应中不同方面的能量变化。
1、定义不同
活化能是动力学参数。它表示发生反应所需要克服的能量壁垒。
为了使反应发生,反应物分子必须发生碰撞,并且其能量必须达到或超过一个临界值,这个临界值对应的能量就是活化能。
活化能主要用于衡量反应的快慢(速率)。活化能越高,反应越难进行,速率越慢;活化能越低,反应越容易进行,速率越快。
反应物的总键能是热力学参数。它表示将1 mol反应物中的所有化学键完全断裂,使其变成孤立的气态原子所需吸收的总能量,是一个可累加的绝对值。
反应物的总键能衡量了反应物分子内所有化学键的总强度。总键能越大,说明反应物分子本身越稳定。
2、表示的反应机理不同
以氢气与氯气的反应为例:
H₂+Cl₂=2HCl
反应物的总键能:断裂 H-H 键需要吸收 436 kJ/mol ;断裂 Cl-Cl 键需要吸收 243 kJ/mol。
总键能=436+243=679 kJ/mol
正反应物的活化能:需通过基元反应分析,该反应通过自由基链式反应机理进行,并不需要一下子断裂所有反应物的化学键。
起始步(链引发):基元反应① Cl₂ → 2Cl•
只需要断裂一个Cl-Cl键(243 kJ/mol)就能引发链反应。
链传递:
基元反应② Cl• + H₂ → HCl + H•
基元反应③ H• + Cl₂ → HCl + Cl•
这是反应的核心阶段。自由基与反应物分子反应,在消耗反应物的同时生成产物分子和新的自由基,使反应像链条一样一环扣一环地持续下去。
这个阶段不需要外界再提供能量。
从这个例子可以清楚地看到:
总键能(679 kJ/mol)是一个巨大的数值,代表了分子的总稳定性。
活化能(243 kJ/mol)则小得多,它取决于反应的具体路径(机理)。
催化剂的存在甚至可以进一步降低活化能,但不会改变反应物的总键能。
3、图像区别
反应物的总键能:在“反应进程—势能图”上,它对应的是反应物能谷与所有原子完全分离状态之间的能量差。
对应的“反应进程—势能图”的顶端横线表示的是原子的总势能。
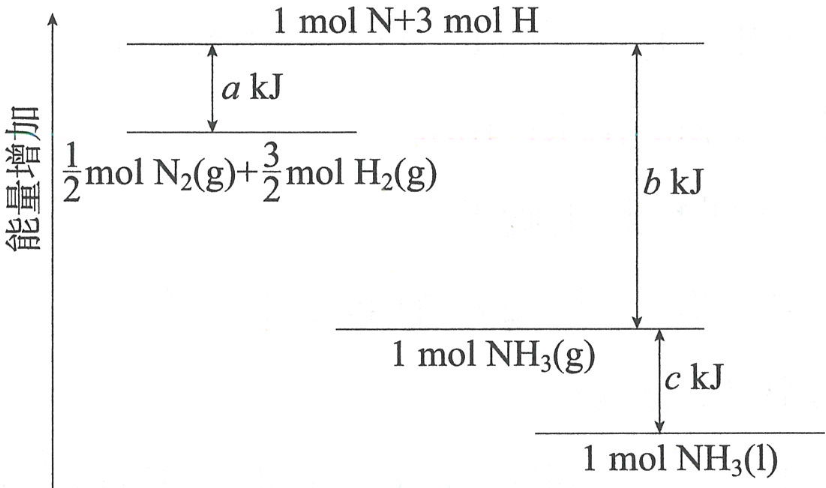
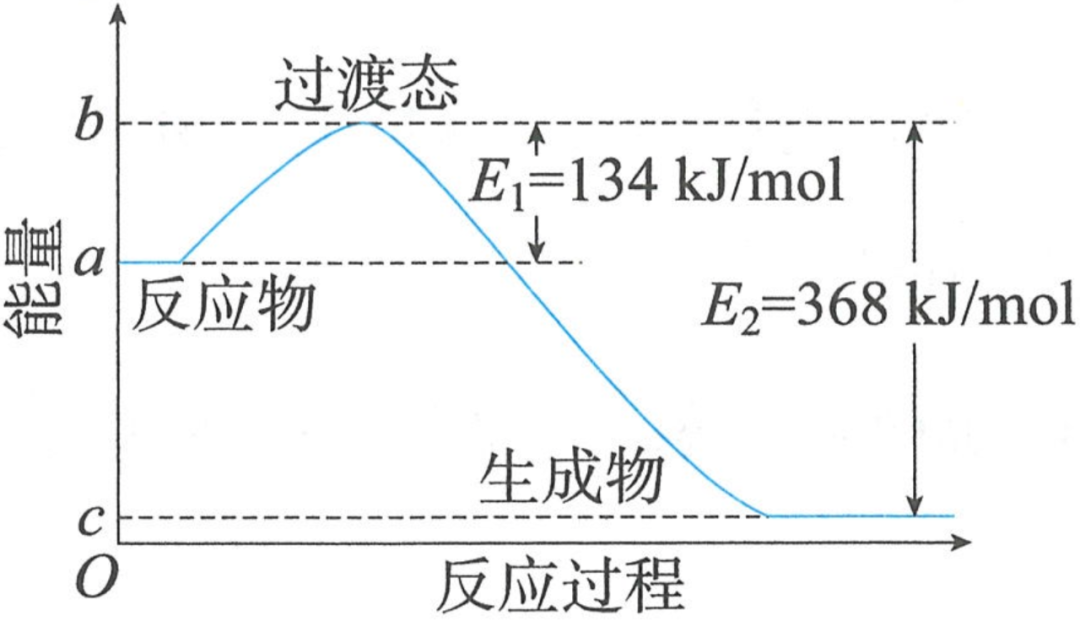
正反应活化能:在“反应进程—势能图”上,活化能是反应物能谷和过渡态(峰值)之间的能量差。
对应的“反应进程—势能图”的顶端(峰值)表示的是过渡态的势能。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
在学习《活化能》时,有学生注意到“反应进程—势能图”与学...
【导读】过渡态是反应中稍纵即逝的能量顶峰,化学键将断未断...
多数盐(如铵盐、弱酸盐)水解为吸热反应,典型的盐类水解(如...
化学反应热力学和动力学的区别与联系如下: 一、热力学和动力...
一、概念梳理 中和热是指在稀溶液中,酸与碱发生中和反应生成...
1.焓是什么?与什么因素有关?物质的具体焓值是否可测? 焓...