
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、什么活化能(Activation Energy,Eₐ)?
活化能是指反应物分子转变为产物分子所需克服的最低能量壁垒。它等于反应物(或前一个中间态)能量与后续过渡态能量之间的差值。
物理意义:活化能决定了反应速率的快慢。活化能越高,能够越过能垒发生反应的分子比例越少,反应速率越慢;活化能越低,反应速率越快。
催化剂的核心作用就是通过改变反应路径(通常是提供表面吸附位点,促进键的断裂和形成),显著降低关键步骤(特别是速率决定步骤)的活化能,从而加速反应。
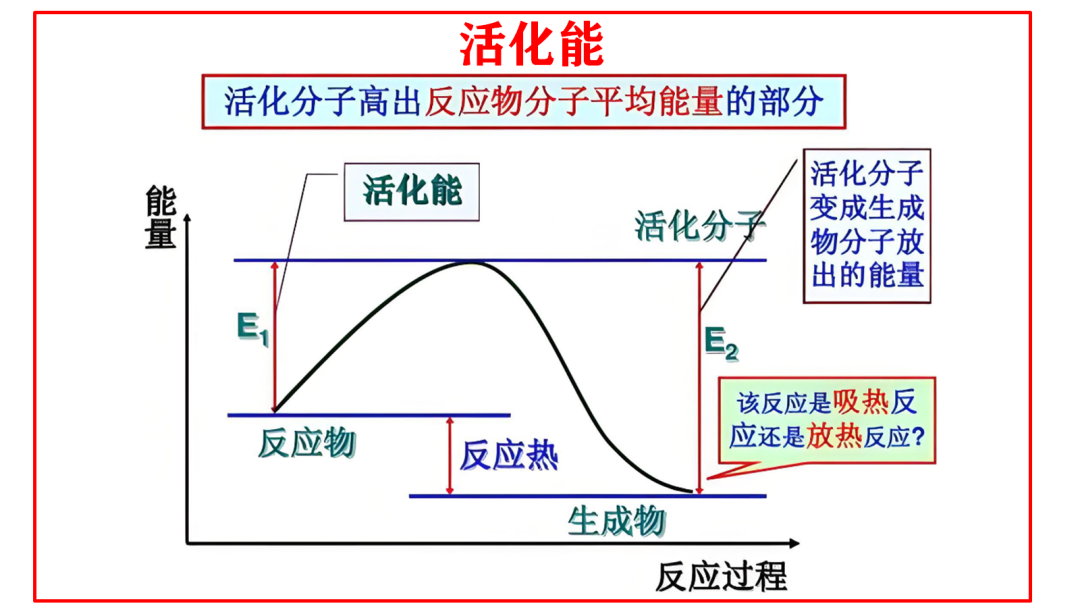
如上面的反应历程图中虽没有直接画出差值箭头,但可以根据能量值计算各步骤的活化能。
如步骤1:N₂吸+3/2H₂吸→N吸+3H吸
①反应物吸附态能量:约-17kJ/mol(N₂吸+3/2H₂吸)
②过渡态1能量:约45kJ/mol
③活化能计算:Eₐ1=45-(-17)=+62kJ/mol
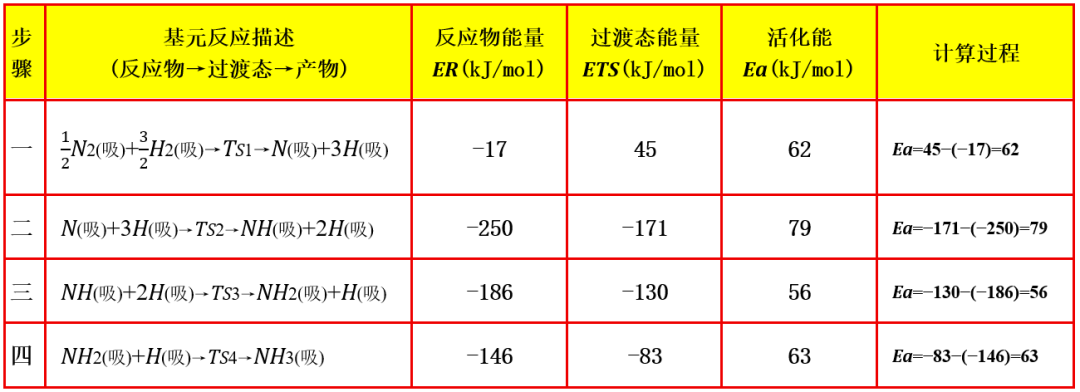
二、什么决速步骤?
速率决定步骤:通常活化能最高的步骤反应最慢,是控制总反应速率的步骤。在这个示意图中,步骤2"N吸+3H吸→NH吸+2H吸"的活化能Eₐ2=79kJ/mol最大,是决速步骤。
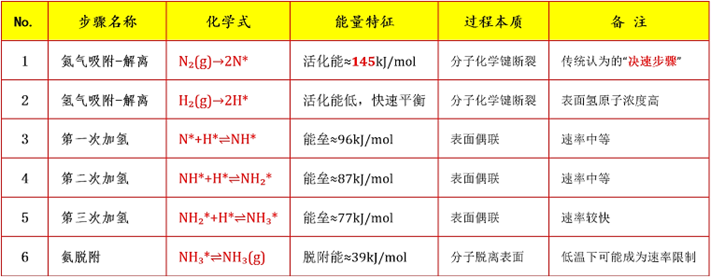
但以上面的反应历程图表中数据与实际情况有所差异,N≡N键能高约946 kJ/mol,断裂需克服的能量壁垒较高,实际N₂在催化剂表面的解离吸附是合成氨反应的速率控制步骤,这个是数据简化或模型假设所致,在此不做探讨。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
在学习《活化能》时,有学生注意到“反应进程—势能图”与学...
【导读】过渡态是反应中稍纵即逝的能量顶峰,化学键将断未断...
多数盐(如铵盐、弱酸盐)水解为吸热反应,典型的盐类水解(如...
化学反应热力学和动力学的区别与联系如下: 一、热力学和动力...
一、概念梳理 中和热是指在稀溶液中,酸与碱发生中和反应生成...
1.焓是什么?与什么因素有关?物质的具体焓值是否可测? 焓...