
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
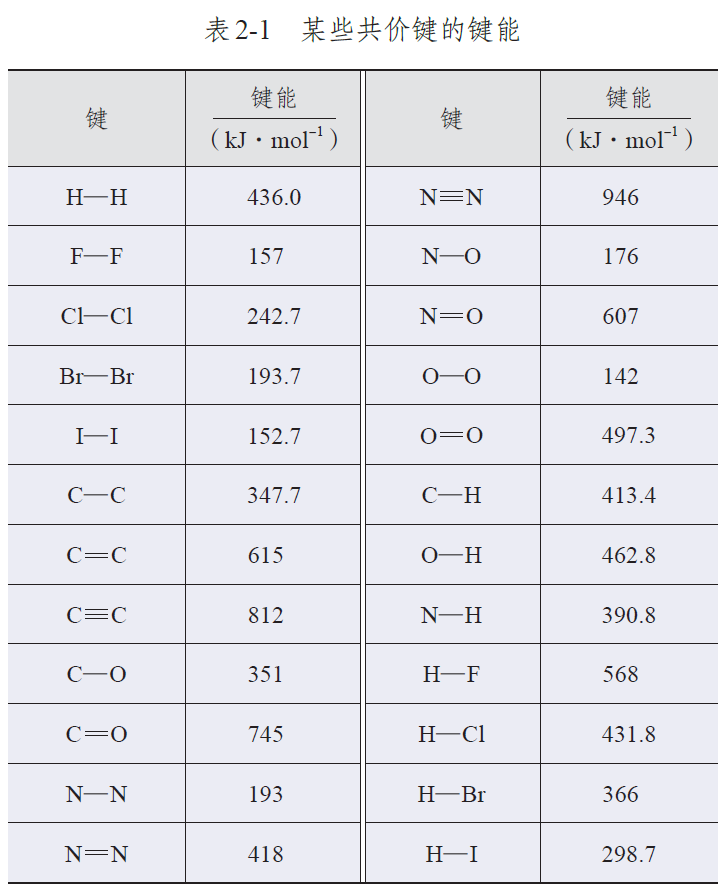
通常而言,同主族元素形成的X-X键,自上而下,键长逐渐增大,键能逐渐降低。 根据元素周期表的信息可知,F是ⅦA族最上方的元素,且F-F的键长较短,按理说键能应该较高,但实际上根据人教版选择性必修二中提供的数据可以看出F-F出现明显反常,反常的低。
共价键 | H-H | F-F | Cl-Cl | Br-Br | I-I | C-C |
|---|---|---|---|---|---|---|
键能kJ/mol | 436.0 | 157.0 | 242.7 | 193.7 | 152.7 | 347.7 |
键长pm | 74 | 141 | 198 | 228 | 267 | 154 |
实际上,由于F原子的半径特别小,键长较短,当两氟原子形成共价键时,原子核间的距离很近,使F-F原子间的【孤电子对】斥力较大。因此F-F键键能反而不大,F-F键的稳定性较差,很容易与其他物质发生反应。
此外,F-F键键能小也与F位于第二周期,不存在空d轨道,不能像Cl,Br,I可以形成d-p π键,而使键加强有关。
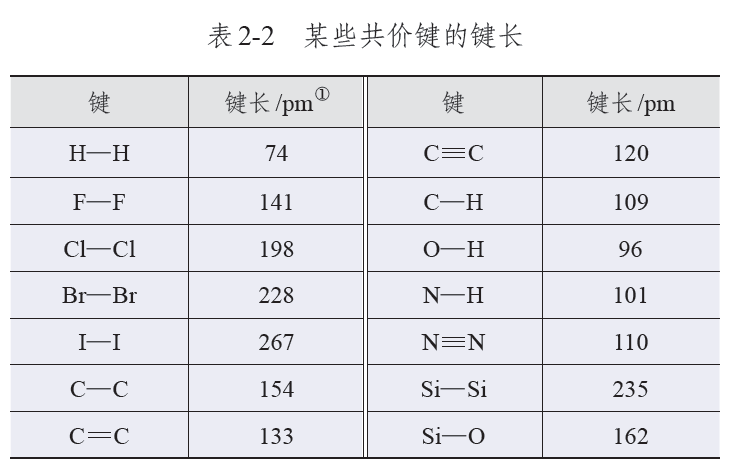
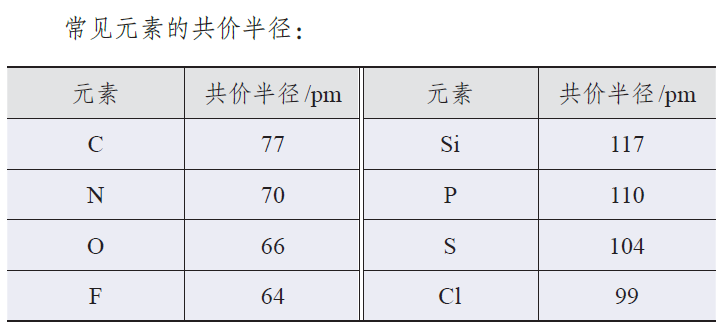
附人教版教材选择性必修二相关数据表格:

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
冠醚是一类大环多醚化合物,其分子结构呈环状,环上均匀分布...
在高考备考化学试卷里,经常会遇到含钯的催化剂。本文将就钯...
在离子晶体中存在离子极化现象,使得离子键带有一定共价键的...
【情境】:你注意到我们每天都离不开的水有什么反常之处吗?...
氢键的大小(强度)可以通过多种因素来比较,这些因素包括氢键...
...