
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
【导读】不是,差别很大。晶格能和离子键键能这两个概念都描述“把离子晶体拆成离子或原子所需的能量”,但拆的方式不同、参考态不同、所需能量也不同。
简言之,晶格能是把晶体拆成气态离子需要的能量(0K,内能);离子键键能是把气相离子对分子拆成中性原子需要的能量(298K,焓变)。
晶格能是离子晶体整体稳定性的体现:它反映1mol离子晶体中所有离子键的总作用效果,晶格能越大,说明整个离子晶体的离子键整体越强,晶体越稳定。
离子键的键能是单个化学键的能量参数:它代表断裂1mol单个离子键所需的能量,键能越大,单个离子键越强。
二者核心都与离子间作用力强弱直接相关,是从不同维度描述离子晶体中作用力的物理量,变化趋势通常一致。当离子键键能增大时,晶格能通常也会随之增大,比如离子电荷越高、半径越小,既会让离子键键能变大,也会让晶格能变大。

一、什么是晶格能?
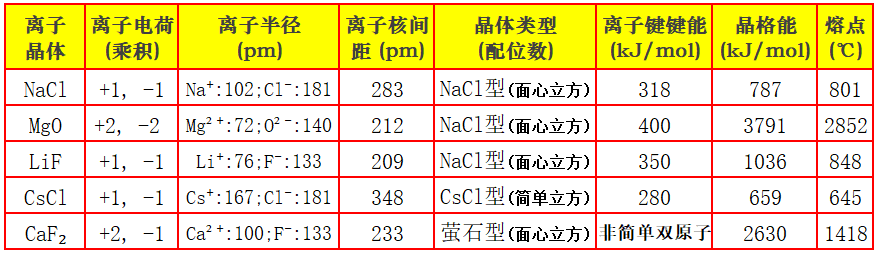
晶格能(U):0K、标准状态下,1mol理想离子晶体直接解离为彼此相距无限远、静止的气态离子时,体系内能的降低值(负值习惯写为正值,故取绝对值)。
NaCl(s)=Na⁺(g)+Cl⁻(g) U≈ΔH≈+787kJ/mol
“0K、标准状态下”:这指出了最严谨的理论计算条件。在0K时,热能的影响被消除,晶格能纯粹反映了离子间静电作用的强度,与晶格的内能变化直接相关。常说的标准状态下的晶格能值,是此理论值或经过热力学循环校正到298K的值。
“1mol理想离子晶体”:强调研究对象的宏观和周期性。
“解离为彼此相距无限远、静止的气态离子”:这是关键。过程的起点是晶体,终点是独立的、未相互作用的离子。产物必须是气态离子,不是中性原子。
“体系内能的降低值(取绝对值)”:从晶体到自由离子,体系能量是升高的,所以内能变化(ΔU)为正值。习惯上,为了使“稳定性的量度”是一个数值越大表示晶体越稳定的正值,采用其绝对值。所以,晶格能(U)在数值上等于|ΔU|。
二、什么是离子键键能?
离子键键能:在气相中,1mol双原子(或“分子片”)离子型分子解离为中性原子时所需的焓变(298K,1bar)。相当于普通共价键的键能(BDE,键解离能),只是对象换成“离子对分子”。
NaCl(g)=Na(g)+Cl(g) D≈ΔH≈+318kJ/mol
“在气相中”:这是此定义成立的前提。它确保了研究对象是一个孤立的离子对,完全脱离了晶体晶格的集体环境。
“1mol双原子和离子型分子:明确了研究对象是微观的“分子”实体,如气相中的NaCl分子。
“解离为中性原子”:这是与晶格能的本质区别。过程的终点不是离子,而是中性原子。这实际上包含了电离能、电子亲和能等步骤的能量总和。
“相当于普通共价键的BDE”:可以将其定位为一种键的解离焓,类比共价键键能,只不过这个键是离子键。
离子键键能测量、计算对象是气相单个离子对分子,与三维晶体无关。
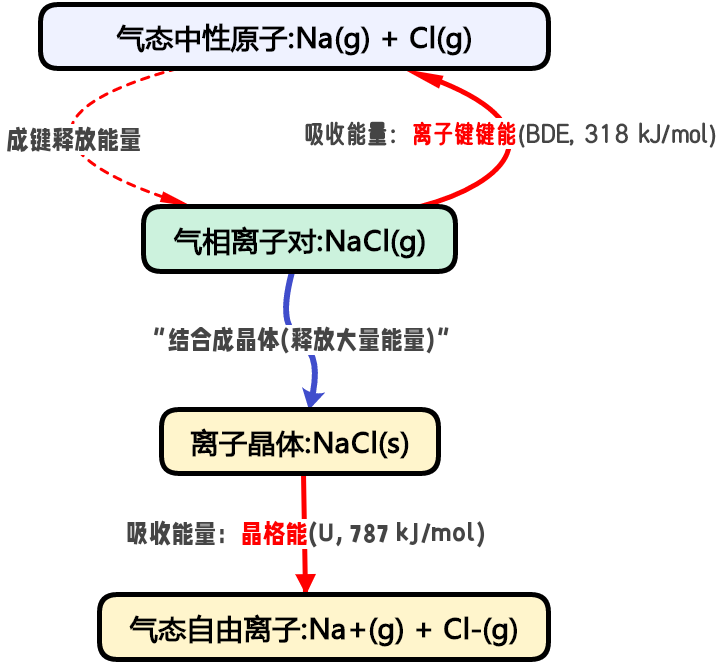
三、晶格能和离子键键能的能量路径图简析
由上图可见:晶格能(U)连接的是离子晶体和气态自由离子;离子键键能(BDE)连接的是气相离子对和气态中性原子。
二者描述的是完全不同物理化学过程中的能量变化。对于一个典型的离子化合物NaCl,其晶格能的数值远大于离子键键能,因为将整个晶体拆散成离子,远比拆散一个孤立的离子对困难得多。
NaCl(s)=Na⁺(g)+Cl⁻(g) U≈ΔH≈+787kJ/mol
NaCl(g)=Na(g)+Cl(g) D≈ΔH≈+318kJ/mol
这个巨大的数值差异(787kJ/mol、318kJ/mol)也再次印证了为什么对于离子晶体,晶格能才是衡量其稳定性和物理性质的更有意义的参数,因为离子在晶体中并不是以独立的“键对”形式存在,而是处于整个晶格的强大静电作用之中。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。在晶体分类体系中,除了分子晶体、共价晶体、金属晶体、离子晶体这四大基础类型外,还...
【导读】水溶液中Cu(II)比Cu(I)更稳定,这看似与电子排布3d比3d更稳定的直觉相悖,但...
【导读】 不是,差别很大。 晶格能 和离子键键能这两个概念都描述“ 把离子晶体拆成离...
专家观点与质疑 乙酸晶胞中究竟包含4个分子还是2个?深入剖析揭示真相。乙酸晶胞实际...
...
...