
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
在化学研究与教学实践中,醋酸钠溶液作为强碱弱酸盐的典型代表,其加热时的离子行为与pH变化常存在认知误区。传统观点认为加热会使醋酸钠溶液中氢离子浓度减小、pH增大,但结合实验测量与理论计算可知,实际变化规律更为复杂,需从多重平衡协同作用的角度深入分析,才能准确把握其本质特征。
一、问题起源:平衡移动与认知矛盾
醋酸钠溶液中同时存在醋酸根离子的水解平衡(CH3COO-+H2O CH3COOH+OH-)与水的电离平衡(H2O
CH3COOH+OH-)与水的电离平衡(H2O H++OH-),且两个平衡均为吸热过程。依据勒夏特列原理,加热本应促使平衡正向移动,导致c(OH-)增大,溶液碱性增强。然而,部分教辅资料与教学认知中,却默认氢离子浓度会随加热减小;更关键的是,不同来源的实验数据显示,相同浓度醋酸钠溶液在相近温度下pH存在明显差异,且升温过程中pH均呈现下降趋势,这与“水解增强则pH增大”的初始认知形成冲突,亟需通过系统研究厘清真相。
H++OH-),且两个平衡均为吸热过程。依据勒夏特列原理,加热本应促使平衡正向移动,导致c(OH-)增大,溶液碱性增强。然而,部分教辅资料与教学认知中,却默认氢离子浓度会随加热减小;更关键的是,不同来源的实验数据显示,相同浓度醋酸钠溶液在相近温度下pH存在明显差异,且升温过程中pH均呈现下降趋势,这与“水解增强则pH增大”的初始认知形成冲突,亟需通过系统研究厘清真相。
二、实验验证:数据揭示真实变化趋势
为探究醋酸钠溶液加热时的具体变化,研究者采用精密仪器开展实验:通过分析天平配制准确浓度的醋酸钠溶液,使用经标准缓冲液(pH=6.864、pH=9.184)校准的pH计,在不同温度下测定溶液pH,并换算为c(H+)同时结合对应温度下水的离子积常数Ka计算c(OH-)

对0.1mol/L 醋酸钠溶液的测试显示,温度从10℃升高至60℃时,溶液pH从8.54逐步降至7.94,c(H+)由2.88×10⁻⁹mol/L增至11.5×10⁻⁹mol/L,c(OH-)则从0.101×10⁻⁵mol/L增至0.837×10⁻⁵mol/L。针对0.5mol/L 醋酸钠溶液的实验也得出相似规律:温度从18.9℃升至60℃,pH从9.35降至8.75,且不同温度下的实测数据与理论推算结果高度吻合,进一步证实了变化趋势的一致性。
三、理论解析:多重常数协同作用的本质
(一)关键平衡常数的温度依赖性
影响醋酸钠溶液离子浓度的核心常数包括水的离子积常数Kw,醋酸的电离常数Ka与醋酸钠的水解常数Kh。其中,Ka温度升高显著增大,60℃时Kw为9.62×10⁻¹⁴)是10℃时(0.292×10⁻¹⁴)的33倍;而Ka变化幅度极小,在25℃左右达到最大值1.765×10⁻⁵,升温后略有下降,60℃时为1.542×10⁻⁵。由于Kh=Kw/Ka的大幅增长远超过Ka的微弱变化,使得Kh温度升高显著增大,进而推动水解平衡正向移动,导致c(OH-)上升。
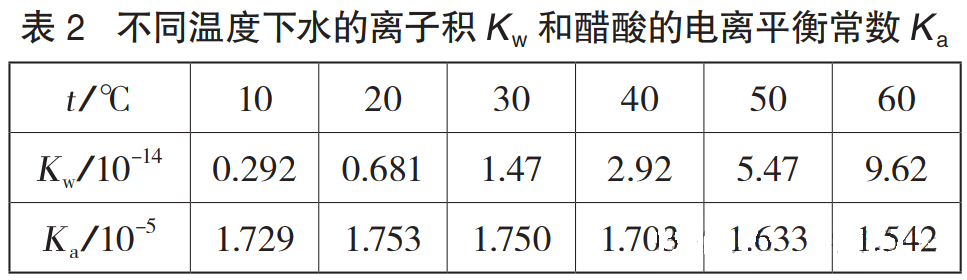
(二)c(H+)增大与pH下降的逻辑推导
根据Kw=c(OH-)×c(H+),虽然c(OH-)加热增大,但Kw增幅更为显著。通过公式推导可得
 (c为醋酸钠溶液浓度),
(c为醋酸钠溶液浓度),
由于Kw增长幅度远超Ka浓度项的影响,最终导致c(H+)温度升高而增大。以0.1mol/L 醋酸钠溶液为例,理论计算显示,温度从10℃升至60℃时,c(H+)由0.711×10⁻⁹mol/L增至3.85×10⁻⁹mol/L,与实验趋势完全一致。

pH作为c(H+)负对数,其变化直接由c(H+)定。尽管加热后溶液中c(OH-)远高于c(H+)保持碱性环境),但c(H+)实质性增大必然导致pH下降。需要注意的是,c(OH-)增大量级(10⁻⁵)远大于c(H+)(10⁻⁹),因此溶液碱性实际仍在增强,pH下降与碱性增强并不矛盾,而是多重平衡协同作用的特殊结果。
此外,醋酸电离过程的特殊性也需关注:低温时(低于25℃),醋酸分子间因氢键作用形成二聚体,电离需先吸热破坏氢键,此时Ka温度升高而增大;温度超过25℃后,氢键作用减弱,电离过程中离子水合释放的热量大于电离吸热,Ka温度升高反而减小。但无论Ka何变化,Kw主导作用始终决定着c(H+)增大趋势。
结论
醋酸钠溶液加热时的离子变化规律,打破了“水解增强必使pH增大”“碱性增强必伴随c(H+)减小”的固有认知。在教学中,需引导学生认识到:盐类水解与水的电离平衡相互关联,不能孤立分析单一平衡;Kw温度敏感性是决定离子浓度变化的关键因素,需重视常数间的定量关系;实验数据是纠正认知偏差的重要依据,应培养基于证据的科学思维。
综合实验测量与理论计算可得出明确结论:醋酸钠溶液加热时,c(OH-)与c(H+)同时增大,且c(OH-)增大占主导地位,溶液碱性增强;由于c(H+)实质性上升,溶液pH呈现下降趋势。这一结论不仅符合化学平衡的基本原理,也为中学化学教学中相关知识点的准确讲解提供了科学依据,有助于学生建立全面、动态的平衡思维,避免被片面认知误导。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
在化学研究与教学实践中,醋酸钠溶液作为强碱弱酸盐的典型代...
1.减小偶然误差 (1)终点判断的主观性:不同人对颜色变化的敏...
一、何谓热冰 冷却的醋酸钠过饱和溶液,暂时处于亚稳态。当受...
问题:测溶液pH能否使用胶头滴管? 讨论1:用胶头滴管吸取溶液...
pH值是什么? pH值,也称氢离子浓度指数、酸碱值,是溶液中氢...
中和滴定 水液洗器切分明, 查漏赶气再调零。 待测液中加试剂...