
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
【导读】离子极化的本质是正离子对负离子电子云的扭曲能力,一般情况下离子极化加强,会导致物质的熔点降低、颜色渐变黄、溶解性下降、共价性增强!
判断其极化强弱时需从正离子的 “极化能力” 和负离子的 “变形性” 两个维度考量分析,具体先看正离子的电荷和半径(核心),再看电子构型,最后结合负离子的变形性,就能解释大部分 “电荷高却熔点低” 的特殊情况。
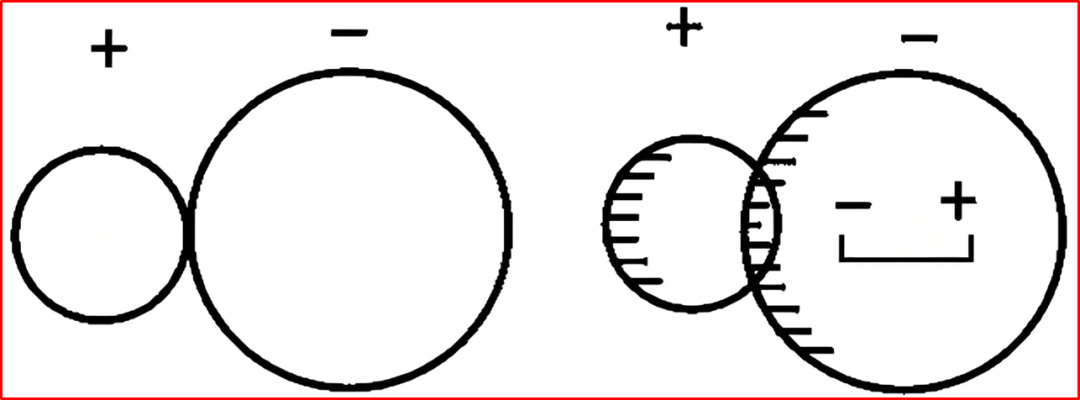
一、什么是离子极化?
正离子(或外电场)把相邻负离子的电子云“拉偏”,使原本球对称的负离子出现诱导偶极的现象。结果使离子键含“共价成分”,键长缩短、键能升高,宏观性质(熔点、沸点、溶解度、颜色、热稳定性、晶型、导电方式、光学/介电性能)随之改变。
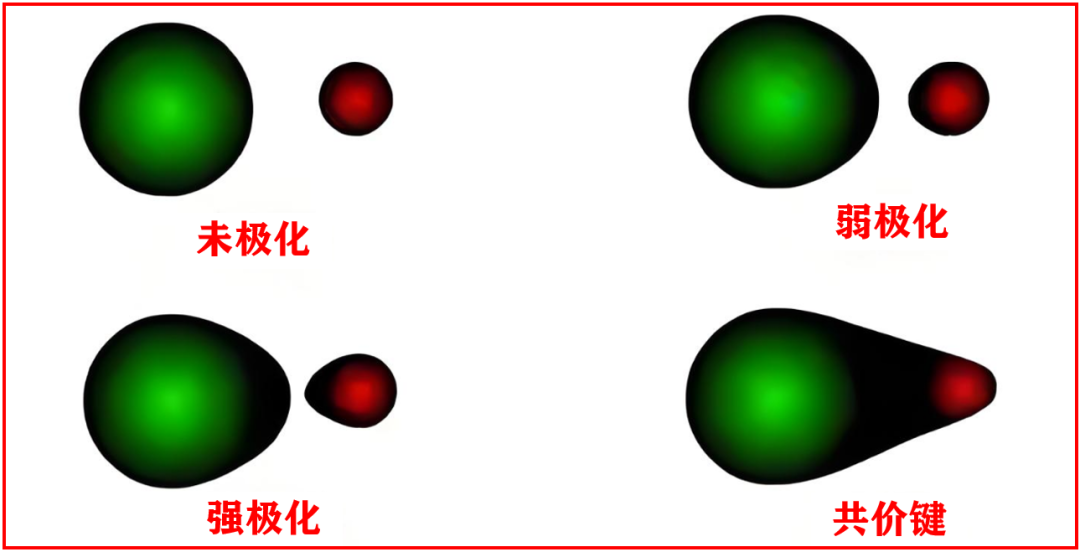
二、极化能力的影响因素是什么?
1.正离子极化能力:半径越小、电荷越多,其极化能力越强。
这是决定极化能力的核心,可用 “电荷/半径比(离子势)” 来量化,C/r比值越大,极化能力越强,就像 “小而重的正电荷” 对电子云的拉扯力更强。
同周期正离子(电子层数相同),电荷越高、半径越小,极化能力越强;同主族正离子(电荷相同),半径越大,极化能力越弱。
2.电子构型的影响:18e⁻≈(18+2)e⁻>9-17e⁻>8e⁻
18电子构型的离子(如 Zn²⁺)外层电子云更“蓬松”,对负离子的吸引力更强,而8电子构型(如 Mg²⁺)外层电子云更“紧凑”,极化能力弱。
相同电荷、相近半径的正离子,电子构型会显著影响极化能力。规律为:18电子构型(如Cu⁺、Zn²⁺)≈18+2电子构型(如Pb²⁺、Sn²⁺)>9-17电子构型(如Fe²⁺、Cr³⁺)>8电子构型(如 Na⁺、Mg²⁺)。
如Zn²⁺(18 电子,74pm)和 Mg²⁺(8 电子,72pm)半径接近、电荷相同,但ZnO的共价性远强于MgO,其熔点(1975℃)低于 MgO(2852℃)。
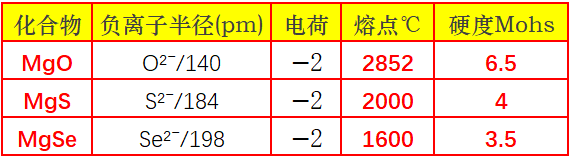
3.负离子变形性:半径越大、电荷越多,负离子变形性越大。
极化是正离子“拉”负离子电子云的过程,负离子越容易被“拉变形”,极化效果越明显。
电荷:负离子电荷绝对值越高,变形性越强(如S²⁻、O²⁻比Cl⁻、F⁻)。
半径:同主族负离子(电荷相同),半径越大(如I⁻>Br⁻>Cl⁻>F⁻),电子云越容易被扭曲。
如MgS 和 MgO,S²⁻(184pm)比 O²⁻(140pm)半径大、变形性强,所以 MgS 的极化程度比 MgO 高,共价性更强,熔点(MgS 约 2000℃)低于 MgO(2852℃)。
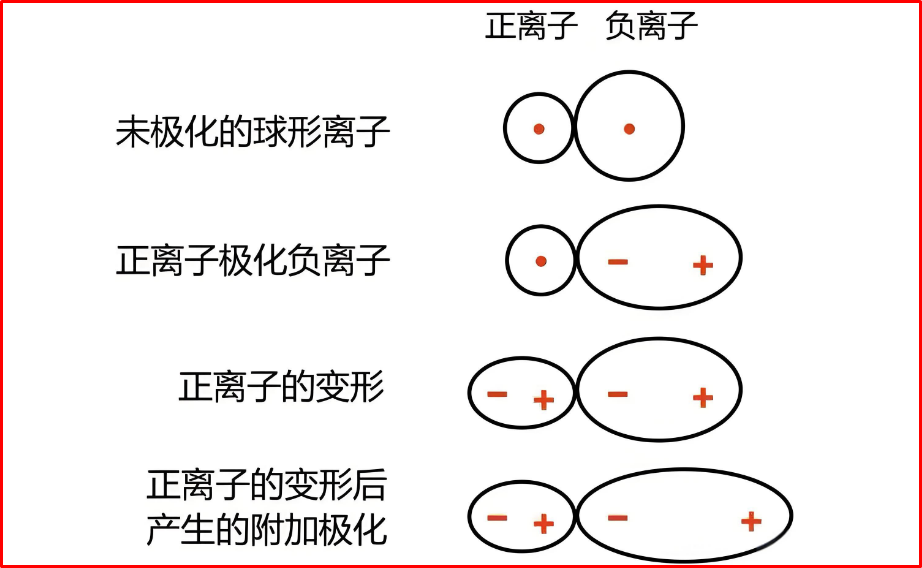
三、离子极化对物质宏观性质影响的对比简析
1.正离子极化能力递增序列(卤化物):正离子电荷越多、半径比C/r越大,熔点越低,共价性越明显。
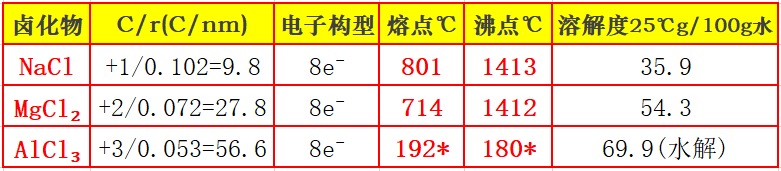
其中AlCl₃加压下升华,已呈共价二聚体。
2.电子构型“作弊”对比:半径相近,18e⁻的Zn²⁺极化能力更强,ZnO共价性增强,熔点降低,带隙减小,颜色由白变化为淡黄。
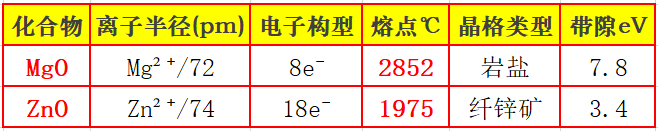
3.负离子变形性递增:负离子半径越大越“软”,极化越强,共价成分越高,熔点、硬度递减。
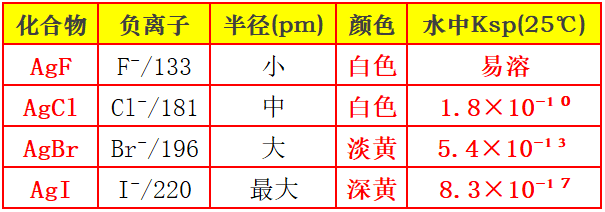
4.同族卤化银颜色与溶解度(18e⁻Ag⁺的强极化):负离子半径越大,变形性越大,极化越强,颜色加深,共价性增强,溶解度降低。
【规律小结】
①“小、多、18”:正离子半径小、电荷多、18e⁻构型,其极化能力大。
②“大、多、下”:负离子半径大、电荷多、最外层电子在下周期,其变形性大。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。在晶体分类体系中,除了分子晶体、共价晶体、金属晶体、离子晶体这四大基础类型外,还...
【导读】水溶液中Cu(II)比Cu(I)更稳定,这看似与电子排布3d比3d更稳定的直觉相悖,但...
【导读】 不是,差别很大。 晶格能 和离子键键能这两个概念都描述“ 把离子晶体拆成离...
专家观点与质疑 乙酸晶胞中究竟包含4个分子还是2个?深入剖析揭示真相。乙酸晶胞实际...
...
...