
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
金刚石(diamond)(又名钻石)是一种无色透明晶体,常呈八面体,有强折光性,硬度大(莫氏硬度为10, 是自然界硬度最大的物质),不导电,熔点超过3500℃,是种典型的原子晶体。下面我们来认识一下这种晶体的结构。
一、金刚石晶体中正四面体结构单元
在金刚石的晶体中,碳原子的采用sp3 杂化,碳原子以共价键形成的一种空间网状结构,每一个碳原子与周围的四个碳原子形成一个正四面体,即正四面体中心的一个碳原子参与形成 4 个C-C单键,这是由于共价键的饱和性和方向性决定的,这样经过任意一个碳原子的任意两条C—C 共价键的键角是 109.5°,每个碳原子对一个C-C单键的"贡献"都是 1/2,所以,正四面体中心的这个碳原子参与形成的C-C单键数目相当于4×1/2=2,故金刚石中,1molC(金刚石)可以形成2molC-C单键。
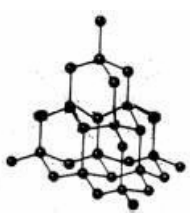
每个最小的正四面体结构单元中的碳原子数和所拥有的C-C共价键键的数目(如上图顶部的正四面体结构单元中),平均拥有的碳原子数为中心的一个碳原子和四个顶点上每个碳原子的即∶1+4×
=2。
平均拥有的C-C共价键数为∶4。
因此,碳原子数与C—C共价键数之比是1∶2。
二、金刚石晶体中的六元环
1.如何理解金刚石晶体中每个碳原子被 12 个六元环共有?
在金刚石晶体中,最小的环为六元环,环中六个碳原子不在同一个平面上(如下图),因每个碳原子可形成四条C—C共价键,则经过任意一个碳原子,任意两条 C—C 共价键可形成两个六元环(如下图),经过任意一个碳原子的任意两条C—C共价键的组合共有6种,这样经过任意一个碳原子的六元环总数为∶6×2=12 个。每个碳原子实际被12个六元环共有。
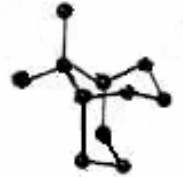
2.每个最小环中,碳原子的平均拥有数是多少或C—C 共价键的平均数是多少呢?
每个碳原子分别属于n个环,则该原子对每个环的贡献只有一,而在金刚石晶体中,每个碳原子应为12个六元环所共有(如上图所指的碳原子),所以每个环实际拥有的碳原子数为∶6(个)×=2。
每条C—C共价键与另外三条C—C共价键可以组合成三种相邻的结构,因此,每条C—C共价键应为6个六元环所共有,这样每个六元环原子的平均拥有数为∶6×=1。
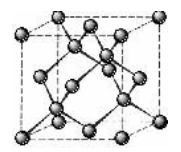
三、金刚石晶胞结构
1.认识金刚石晶胞结构
金刚石晶胞结构为立方晶系,是面心立方格子,碳原子分布于8个顶角和6个面心,同时在晶胞内部有4个碳原子位于4条体对角线的1/4、3/4处,每个原子周围都有4个碳原子,配位数为4,碳原子之间形成共价键,一个碳原子位于正四面体的中心,另外4个与之共价的碳原子在正四面体的顶角上。因此,金刚石晶胞是立方面心结构,即 A4结构。
2.金刚石晶胞中碳原子数是多少?
每个晶胞内含碳原子数=8 个顶角×+6 个面心×
+内部有 4 个碳原子×1=1+3+4=8,每个金刚石晶胞实际含有8个碳原子。
四、晶胞边长怎样计算
若已知 C—C 共价键 的键长为0.154nm,在这种晶胞中,原子在正方体的边长和面对角线的方向都没有相互接触,而是在体对角线方向相互接触,尽管在体对角线方向少两个原子,但从几何关系已经可以建立碳原子半径r与晶胞常数(晶胞边长)a 的关系①。即体对角线的 1/4是C-C键长,约为碳原子半径的8倍、假设碳原子的半径为r,晶胞边长a为,则a=8r,
![]()
五、晶胞中碳原子的空间利用率
A4 型结构是金刚石型堆积,点阵形式是立方面心,有四个结构基元,每个晶胞实际含有8个碳原子,因此一个晶胞中碳原子的体积为
V=8×πr3
晶胞的体积为
![]()
则金刚石晶胞中碳原子的空间利用率为∶
![]()
六、利用晶胞常数计算晶体密度
在一个晶胞中,所含碳原子的质量为12.01g/NA,晶胞的 体 积 为 V=a3=(0.356nm)3,则晶体 的密 度 为
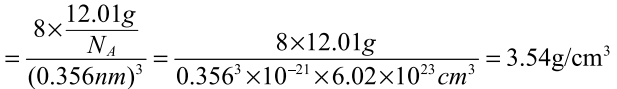

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
无水硫酸镁(MgSO₄)溶解在水里发热,其实是一个非常典型的溶...
离子液体(Ionic Liquids, ILs)是完全由离子构成、在室温或接近室...
分析硝酸铵、碳酸钠、氯化钙与氢氧化钠的溶解热,能清晰掌握...
中学化学选修3-物质结构与性质里介绍了物质结构,其中晶体结...
我们从高中化学的角度来认识一下离子液体。想象一下,如果食...
导语:想象一下,我们把原子看成是搭建豪宅(晶胞)的积木。...