
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
高中教学中,电负性差值是一种非常简单的判断化学键键型的方法:成键的两种元素电负性差值小于1.7即为共价键(或者说以共价键为主),大于1.7即为离子键(或者说以离子键为主)。但这是很粗糙,并且不能够完全适用的方法。举几个例子来说明:金属Na中元素的电负性差值为0,却不是共价键;Al与Mg的电负性差值只有0.3,Mg-Al合金也不存在共价键;F与B的电负性差值高达2.0,BF3却是共价型。
Ketelaar三角判断化学键的键型是非常可靠且全面的(仅限于二元化合物)。
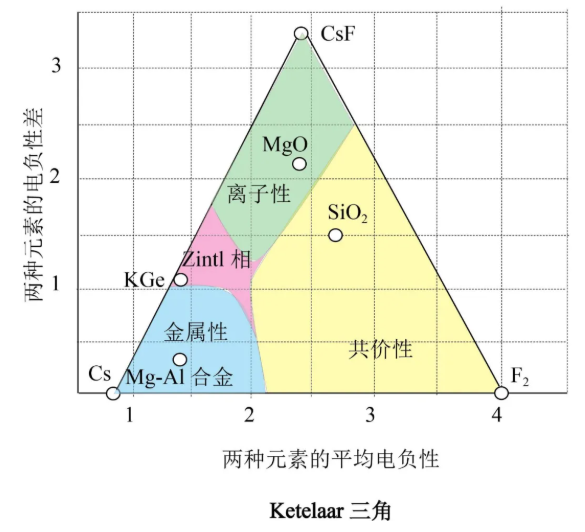
离子性成键作用是用大的电负性差表征的。因为大的差值表明其中一种元素的电负性很高,另一种元素的电负性很低,平均电负性值必定处于两个值之间。例如化合物CsF(电负性差值3.3,平均电负性值2.35)处于Ketelaar三角离子性区域的顶角,这是离子性最强的位置。共价性成键作用是用小的电负性差表征的,这类化合物处于Ketelaar三角的底部。以共价键键合为主的化合物通常是由电负性高的非金属元素形成的,这意味着Ketelaar三角的共价区域是在较低的右角。这个角的顶点由F2(电负性差值0,平均电负性值4.0,这是平均电负性的最大值)占据。金属性成键作用也由小的电负性差所表征,也处于Ketelaar三角的底部。然而金属性成键中电负性低,因而电负性平均值也低,该区域位于Ketelaar三角左边较低的角落。这个角的顶点由金属Cs(电负性差值0,平均电负性值0.7,这是平均电负性的最小值)占据。这里比较特殊的区域是Zintl相区域,这是既有金属性成键作用又有离子性成键作用的区域,如KGe合金(K4Ge4),就是K+离子填入[Ge4]4 -离子构成的面心立方的空隙中形成的既有离子晶体特征又有金属晶体特征的化合物。
可见,使用Ketelaar三角比只使用电负性差来判断键型的优点在于,它让我们能够区分共价性成键和金属性成键,两者的电负性差值都很小。回到本文第一段落的问题,读者可以寻找BF3在Ketelaar三角中的位置,您会发现它在共价性区域。
参考文献:
Weller Overton.Routke Armstrong.Inorganic Chemistry(6th edition)[M].高等教育出版社,63-64

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
一般来说,同主族元素形成的R-R键键能从上至下,键长逐渐增大...
离子极化与影响元素 离子极化理论是离子键理论的重要补充。...
原子之间形成共价键时,若共用电子对只是由一方原子提供电子...
p区元素化学的学习中我们常常发现,很多非金属含氧酸的游离酸...
不是的。 只能提供一对孤对电子与中心原子形成配位键,被称为...
磷的含氧酸共有四种: 磷酸(H 3 PO 4 ),结构式 :三元中强酸...