
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
原电池:化学能转变为电能的装置,它利用化学反应中的电子转移产生电流。最简单的原电池就是铜锌电池,在该电池中,为什么电子从锌片流向铜片?为什么Cu为正极,Zn为负极?其实是铜片的电势比锌片要高,产生了电势差。
电极电势可以由物理实验测出。换句话说,只要有电势差就可以构成原电池,不需要传统的自发氧化还原反应。浓差电池就是其中的例子。
我们查表得到的都是标准电极电势,即溶液浓度是1mol/L,如果是气体,压强是100KPa ,这样的前提下的电势,如果不是这样的条件的话,需要能斯特方程进行修正计算,可得到其他浓度的溶液(或者其他压强的气体)的电极电势。
本篇我们计算浓差电池的电势差,从而计算反应进行的原因和程度。
1、氢离子浓差电池计算电势差

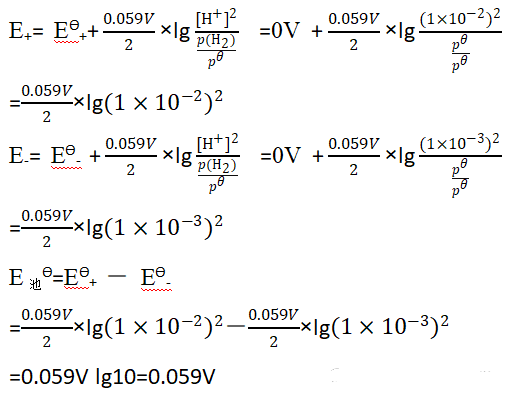
小结:
这里的原电池,其正极和负极都是氢电极,两极之间的不同仅在于溶液的浓度有差别,这种原电池成为浓差电池。
电池反应为:
H+(浓溶液中的)=H+(稀溶液中的)
H+从浓溶液向稀溶液中转移,当两池浓度相等,即浓差消失时,E=0。
也可以带入电动势的能斯特方程:
2、Cu2+浓差电池的计算

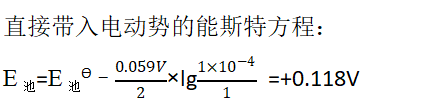
小结:
当E池=0.2V时,K就可以达到 103数量级,反应进行的程度就已经相当大了。
浓差电池之所以能发生,是因为浓度差引发了电势差,反应自然发生。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。并非所有放热反应都可以设计为原电池。能否设计为原电池的关键在于反应必须是自发的氧...
空穴在半导体和绝缘体中扮演着重要角色,在化学中空穴缺电子,对电子本身渴望所以要得...
一、天然冰晶石(NaAlF)的发现:18世纪的格陵兰矿物探索 天然冰晶石的首次记录可追溯...
【导读】“正/负”看电势,按照电势高低,高正低负,绝不互换;“阴/阳”看反应,装置...
在电化学实验中,我们经常遇到一个关键部件——盐桥。它看似简单,却对原电池的正常工...
【导读】浓差电池是以氧化还原为工具、以浓度差为本质的特殊电化学装置。浓差电池的原...