
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、共价键
(弄懂共价键的成键过程,对理解大л键和杂化轨道很有用)
1、共价键是原子间通过共用电子对所形成的相互作用。
共价键分为σ键和л键。
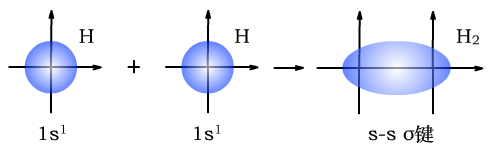
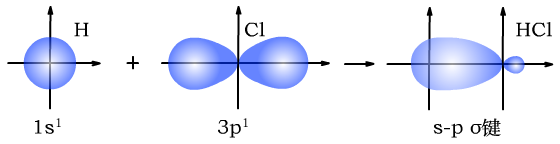
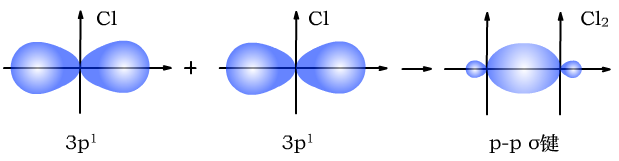
(1)σ键是s轨道的电子或p轨道的电子通过“头碰头”的方式重叠形成的共价键。
σ键的电子云以形成化学键的两原子核的连线为轴做旋转操作,共价键的电子云形状不变,具有轴对称性。
σ键有三种,s-sσ键、s-pσ键、p-pσ键。
H与H形成s-sσ键时,形成过程如下图所示:
H与Cl形成s-pσ键时,形成过程如下图所示:
Cl与Cl形成p-pσ键时,形成过程如下图所示:
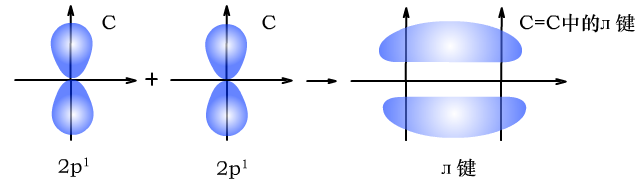
(2)л键是p轨道的电子与p轨道的电子通过“肩并肩”的方式重叠形成的共价键。
л键的电子云由两块组成,它们互为镜像,具有镜面对称性。
C与C形成碳碳双键时的л键形成过程如下图所示:
2、C=C、C≡C中σ键和л键的形成过程。
(1)C=C中σ键和л键的形成过程
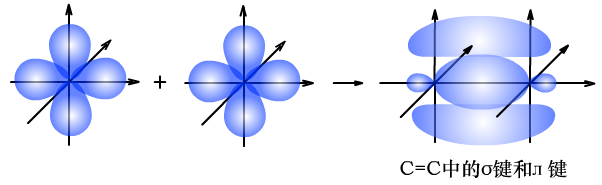
(2)C≡C中σ键和л键的形成过程
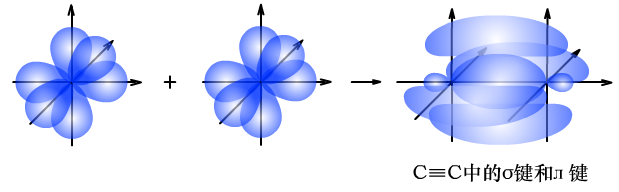
由于л键形成时,相互平行的p轨道电子云距离较远,重叠程度较差,牢固程度低,比较容易断裂。所以乙烯、乙炔中的л键易断裂,发生加成反应,而在此过程中,σ键强度大,并未发生断裂。
从上面可以看出,共价单键只有一个σ键。共价双键有一个σ键和一个л键。共价三键有一个σ键和两个л键。
1、键长
(1)键长是构成化学键的两个原子的原子核之间的距离,单位一般是pm(1×10-12m)。
注意:两原子之间的键长,不会等于两个原子的原子半径的加和。
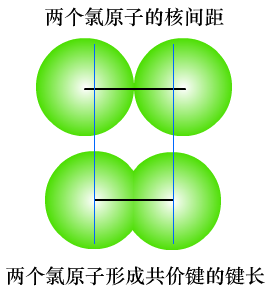
形成共价键后原子的原子半径又叫共价半径,共价半径不是单原子的原子半径。类似的概念还有离子半径、金属半径等。
(2)决定键长的几个因素
①原子半径:原子半径越大,键长越长。
F-F<Cl-Cl<Br-Br<I-I
H-F<H-Cl<H-Br<H-I
C-H>N-H> O-H>F-H
②共价键型:两原子之间的共用电子对数越多,键长越短。
C-C>C=C>C≡C。
2、键能
(1)键能是指气态分子中1mol共价键解离为气态原子时吸收的能量,单位为kJ·mol-1。
(2)决定键能大小的几个因素
①结构相似的化学键,原子半径越大,键长越大,键能越小。
Cl-Cl>Br-Br>I-I
H-F>H-Cl>H-Br>H-I
C-H<O-H<F-H
但F-F<Cl-Cl,N-H<C-H。
②共价键型:两原子之间的共用电子对数越多,键能越大。
C-C<C=C<C≡C
N-N<N=N<N≡N
(3)键能会影响到物质的稳定性,键能大的物质的稳定性强。
在稳定性上,H-F>H-Cl>H-Br>H-I。
3、键角
(1)键角:两个相邻共价键之间的夹角。
它是指同一原子上两个共价键之间的夹角。
CO2分子的键角为180°,它是直线形分子。H2O的键角为105°,它是V形分子。CH4的键角为109°28”,它是正四面体形分子。
(2)键角的意义:
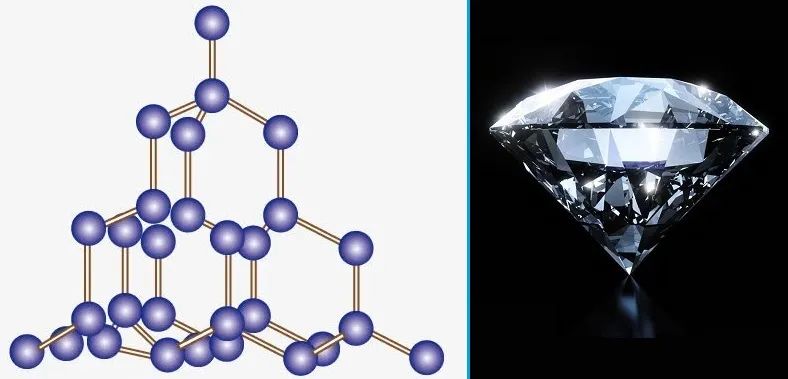
键角决定了分子或晶体的空间结构。
金刚石的空间结构与键角有关。
冰的空间结构与键角有关。

(3)键角大小的比较
①CH4、NH3、H2O的键角比较
| 分子 | 键角 |
CH4 | 109.5° |
NH3 | 107.3° |
H2O | 105° |
CH4>NH3>H2O
原因是孤电子对对共用电子对的排斥力大于共用电子对对共用电子对的排斥力。CH4与NH3相比,NH3有孤电子对,使键角收缩。NH3与H2O相比,H2O的孤电子对更多,键角收缩得更厉害。
②NH3、NF3的键角比较
分子 | 键角 |
NH3 | 107.3° |
NF3 | 102.5° |
NH3> NF3
原因是NF3中,F对共用电子对的吸引力大,共用电子对偏向于F,使共用电子对之间的距离变远,排斥力变小,键角变小。NH3中,H对共用电子对的吸引力小,共用电子对偏向于N,使共用电子对之间的距离变近,排斥力变大,键角变大。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。绪言 1 、 17 世纪中叶,化学开始走上以 科学实验 为基础的发展道路。 2 、 近代化学...
一、配合物 1 、 CuSO 4 固体是白色的, CuCl 2 固体是棕黄色的, CuBr 2 固体是深褐...
一、金属晶体与金属键 1 、固态的金属都是晶体,称为金属晶体。 金属晶体中,金属原子...
一、共价键 (弄懂共价键的成键过程,对理解大 л 键和杂化轨道很有用) 1 、共价键是...
一、能层与能级 1 、核外电子的分层 核外电子在能量不同的区域内运动,简化为电子层,...
离子、原子、分子之间通过什么作用力形成宏观物质呢? 有些靠化学键,有些靠分子间作...