
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
柏拉图立体
一、分子结构的测定方法之一——红外光谱法
分子中不同的化学键会吸收不同频率的红外线能量。
当一系列频率的红外光线经过分子时,会在某些频率上产生能量吸收,记录成红外光谱图。
将它与已有谱图库比对,就能知道分子中有哪些化学键,从而确定分子结构。
【例】

上图为乙醇的红外光谱图谱,可以看出乙醇分子中有C-O、C-H、O-H等,再根据乙醇的分子式C2H6O,推理出乙醇的结构简式为CH3CH2OH。
二、多样的分子空间结构
分子的空间结构是指分子中原子的几何关系和形状。
| 分子 | 空间结构 | 球棍模型 |
CO2 | 直线形 |
|
H2O | V形(角形) |
|
HCHO | 平面三角形 |
|
NH3 | 三角锥形 |
|
CH4 | 正四面体形 |
|
其它的一些分子的空间结构如下图:
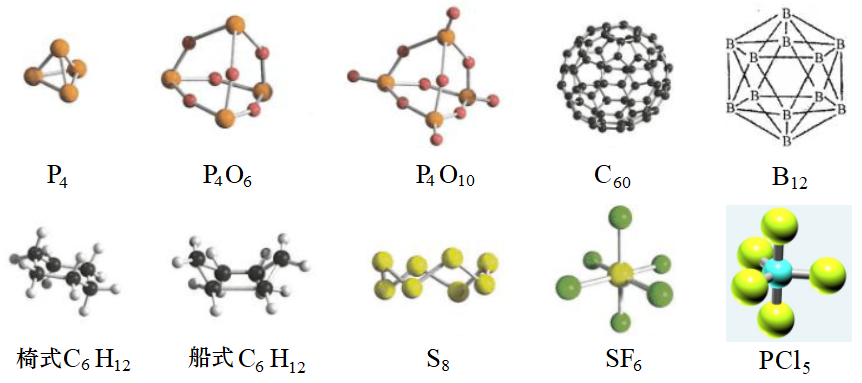
P4为正四面体形,SF6为正八面体形,B12为正二十面体形,PCl5为三角双锥形。
三、价层电子对互斥模型
(如果会写一些简单分子的电子式,价层电子对互斥模型学起来会容易一些。)
1、互斥
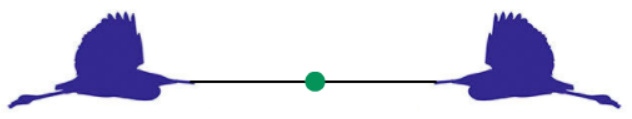
(1)二力互斥:当两只飞鸟被绳拴着,向相反的方向飞时,绳会被拉成一条直线。
(2)三力互斥:当三只飞鸟被绳拴在一个点,向相反的方向飞时,绳会被拉成一个平面。
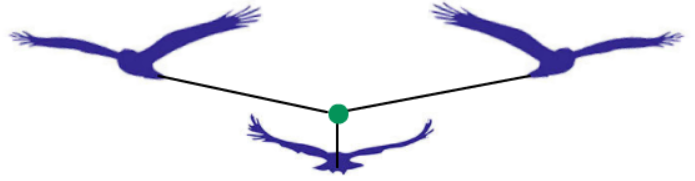
(3)四力互斥:当四只飞鸟被绳拴在一个点,向相反的方向飞时,绳会被拉成一个四面体形结构。
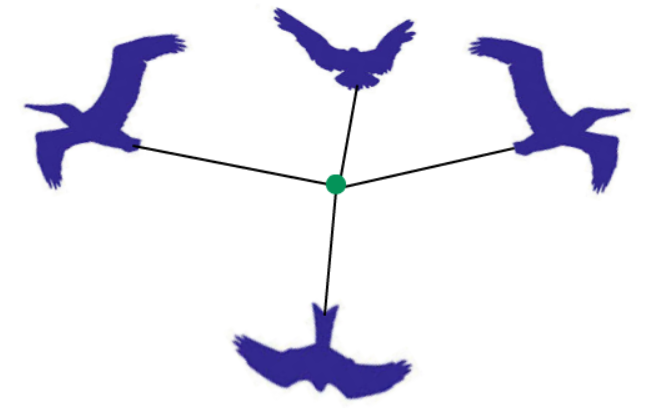
而每一只鸟,在分子结构中,就相当于是某个中心原子周围的一对孤电子对或两个原子之间的共用电子对(不一定是一对)。
2、价层电子对互斥模型(VSEPR model)
(1)价层电子对数:分子中的中心原子与结合原子之间的σ键电子对数和孤电子对数之和。
σ键电子对数的算法:中心原子周围有几个原子,就有几个σ键电子对。
孤电子对数的算法:(中心原子的价电子数-周围原子成键需要的电子数)/2。
【例】HCN分子中,C周围的σ键电子对数为2,孤电子对数为(4-1-3)/2=0,C周围的价层电子对数为2+0=2。
【注意】对于阳离子来说,中心原子的价电子数要减去电荷数(绝对值)。对于阴离子来说,中心原子的价电子数要加上电荷数(绝对值)。
(2)价层电子对数与VSEPR模型之间的关系
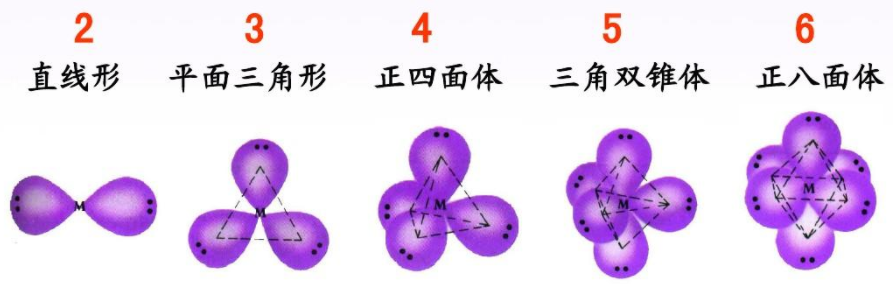
(3)VSEPR模型与分子空间结构模型之间的关系
分子空间结构模型是VSEPR模型去掉孤电子对后的空间形状。
下面是四种分子的VSEPR模型:
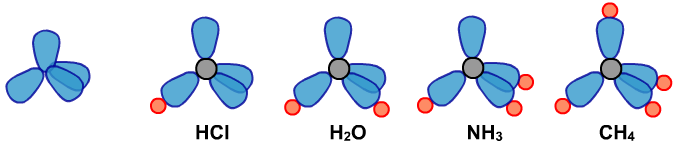
下面是四种分子的空间结构模型:
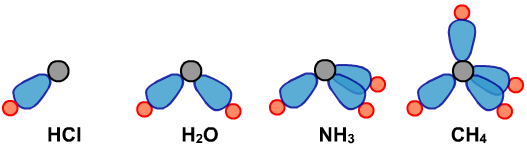
【例】推理ClO3-的空间结构模型
①ClO3-的Cl原子的价层电子对数:
σ键电子对数为3,孤电子对数为(7+1-3╳2)/2=1,C周围的价层电子对数为3+1=4。
②ClO3-的VSEPR模型为四面体形。
③ClO3-的空间结构模型为三角锥形。
四、杂化轨道理论简介
这是解释分子立体结构的另一种理论。
1、为什么提出杂化轨道理论?
原子周围的4对电子,有一对是s轨道的,有三对是p轨道的,它们的空间分布状态并不相同。而我们实际测得的CH4的立体构型是正四面体形。这说明C周围的四对电子的空间分布是完全相同的。
为了解决这个问题,鲍林提出了杂化轨道理论。
2、杂化轨道理论
(1)在成键的过程中,由于原子间的相互影响,同一原子中几个能量相近的不同类型的原子轨道,重新分配能量和确定空间方向,组成数目相等的新原子轨道,这种轨道重新组合的方式称为杂化,杂化后形成的新轨道称为杂化轨道。
(2)杂化轨道有利于原子轨道间最大程度地重叠,所以杂化轨道比原来轨道的成键能力强。杂化轨道之间在空间中取最大夹角分布,使相互间的排斥能最小,形成的键较稳定。
3、杂化类型
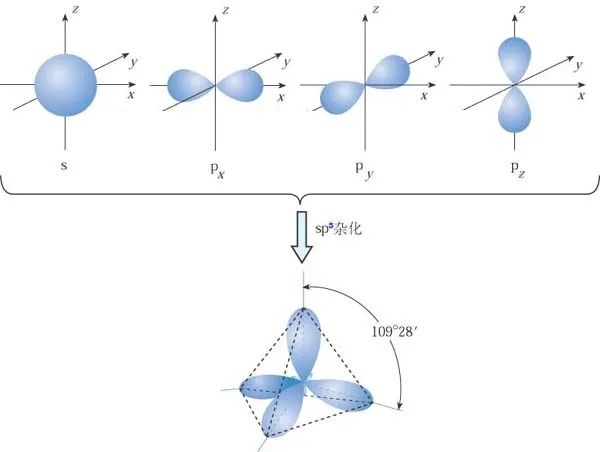
(1)若有一个s轨道与三个p轨道发生杂化,则叫sp3杂化。如H2O、NH3、CH4。
以CH4中C原子的sp3杂化为例
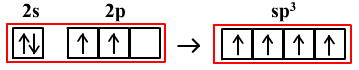
sp3杂化需要4个轨道,2s能级和2p能级上共4个轨道都参与杂化。
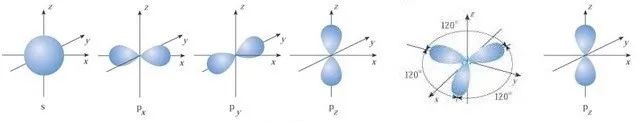
(2)若有一个s轨道与两个p轨道发生杂化,则叫sp2杂化。如C2H4、HCHO、BF3。
以C2H4中C原子的sp2杂化为例
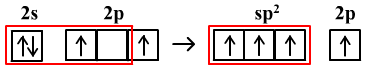
sp2杂化需要3个轨道,2p能级上要保留1个轨道和1个电子用于形成π键。
(3)若有一个s轨道与一个p轨道发生杂化,则叫sp杂化。如C2H2、CO2、HCN。
以C2H2中C原子的sp杂化为例
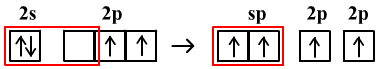
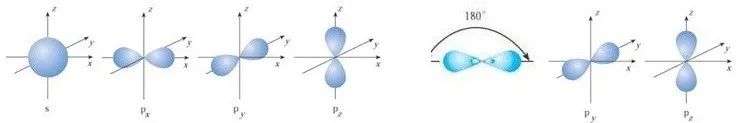
sp杂化需要2个轨道,2p能级上要保留2个轨道和2个电子用于形成2个π键。
(4)若有一个s轨道与三个p轨道、一个d轨道发生杂化,则叫sp3d杂化,如PCl5。(次外能层全充满时)
(5)若有一个s轨道与三个p轨道、两个d轨道发生杂化,则叫sp3d2杂化,如SF6。
(6)还有dsp3、d2sp3等杂化方式。
d写在前面,指上一能级的d轨道与下一能级的s轨道、p轨道进行杂化。(次外能层没有全充满时)
d写在后面,指同一能级的s轨道、p轨道、d轨道进行杂化。(次外能层全充满时)
4、杂化轨道数目推理与杂化类型的推理方法
价层电子对数=杂化轨道数目。
| 价层电子对数 | 杂化轨道数目 | 杂化类型 |
2 | 2 | sp杂化 |
3 | 3 | sp2杂化 |
4 | 4 | sp3杂化 |
5 | 5 | sp3d杂化 或dsp3杂化 |
6 | 6 | sp3d2杂化 或d2sp3杂化 |

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
绪言 1 、 17 世纪中叶,化学开始走上以 科学实验 为基础的发展...
一、配合物 1 、 CuSO 4 固体是白色的, CuCl 2 固体是棕黄色的,...
一、金属晶体与金属键 1 、固态的金属都是晶体,称为金属晶体...
一、共价键 (弄懂共价键的成键过程,对理解大 л 键和杂化轨...
一、能层与能级 1 、核外电子的分层 核外电子在能量不同的区域...
离子、原子、分子之间通过什么作用力形成宏观物质呢? 有些靠...