
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
键的极性和分子的极性会物质的物理性质和化学性质。
一、共价键的极性
1、键的极性和分子的极性
(1)共价键分为极性键和非极性键。
极性键:组成键的两个原子不相同,共用电子对会发生偏移,偏离的原子显正电性,偏向的原子显负电性,整个键显极性。
Hδ+ : Clδ-
非极性键:组成键的两个原子相同,共用电子对不会发生偏移,两个原子都不显电性,整个键没有极性。
H : H
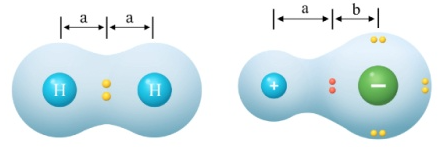
(2)分子分为极性分子和非极性分子。
极性分子:分子的正电中心和负电中心不重合,使分子的某一部分呈正电性,另一部分呈负电性,整个分子显极性。
如HCl、H2O、NH3等。
非极性分子:分子无正电中心和负电中心,或分子的正电中心和负电中心相互重合,整个分子不显极性。
如Cl2、CO2、CH4、BF3等。
注意:O3是极性分子。
2、键的极性对化学性质的影响
(1)FCH2COOH的酸性大于CH3COOH的原因
F的电负性大,得电子能力强,对共用电子对的拥有能力强,使各原子之间的共用电子对发生了如图所示的移动,导致OH键的极性增强,H更容易电离为H+,酸性增强。
F←CH2←CO←O←H
(2)CH3COOH的酸性小于HCOOH的原因
CH3-是推电子基团,
比H的推电子能力强,使各原子之间的共用电子对发生了如图所示的移动,导致OH键的极性减弱,H不容易电离为H+,酸性减弱。
CH3→CO→O→H
烃基越长,推电子能力越强,与羧基相连形成的酸的酸性越弱。
二、分子间的作用力
由分子组成的液态物质或固态物质中,分子和分子之间有分子间作用力。
在高中阶段,分子间的作用力主要区分为范德华力和氢键两种。
1、范德华力及其对物质的性质的影响
因为分子的质量、极性等而形成的作用力属于范德化力。
(1)相对分子质量越大,范德化力越大。
下表是卤素单质的熔点和沸点
| 单质 | 熔点(/℃) | 沸点(/℃) |
F2 | -219.6 | -188.1 |
Cl2 | -101 | -34.6 |
Br2 | -7.2 | 58.78 |
I2 | 113.5 | 184.4 |
F2、Cl2、Br2、I2,随着相对分子质量的增大,分子之间的作用力变大,对应固体的熔点和液体的沸点都在升高。
(2)分子的极性越大,范德化力越大。
下表是F2和HCl的熔点和沸点
| 物质 | 熔点(/℃) | 沸点(/℃) |
F2 | -219.6 | -188.1 |
HCl | -114.2 | -85.1 |
虽然HCl的相对分子质量比F2小,但熔点和沸点高。这是因为HCl的极性比F2要大。
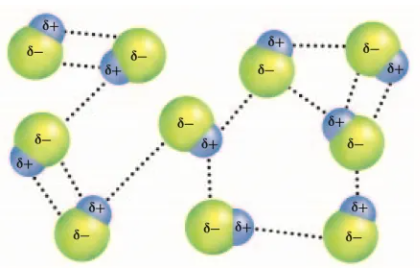
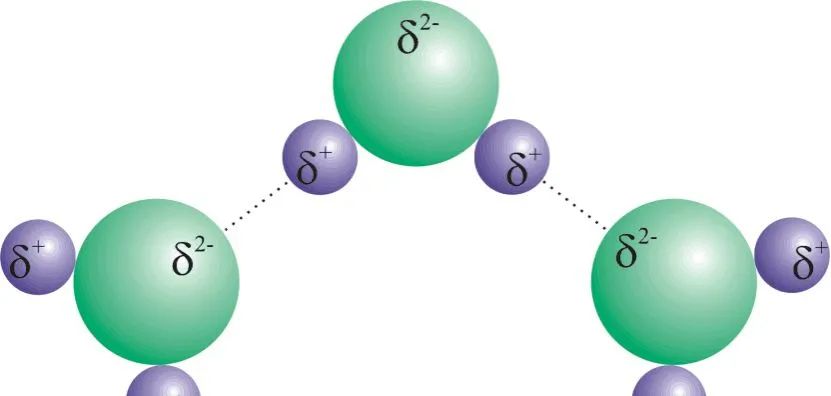
极性分子之间的相互作用
2、氢键及其对物质的性质的影响
(1)氢键是另一种分子间作用力,由已经与电负性很大的原子形成共价键的H与另一个电负性很大的原子(F、O、N)之间形成的作用力。
一般表示为X-H…Y-。
液态或固态的水分子和水分子之间有氢键。
氢键增大了分子之间的作用力。
下表是CH4和H2O的熔点和沸点
物质 | 熔点(/℃) | 沸点(/℃) |
CH4 | -182.6 | -161.4 |
H2O | 0 | 100 |
CH4的相对分子质量与H2O的相差不大,但熔点和沸点比H2O的低很多,原因是液态或固态的H2O之间有氢键。
水的氢键
H2O之间的氢键还导致了水形成冰时,结构上有了方向感,使冰的密度小于水的密度。
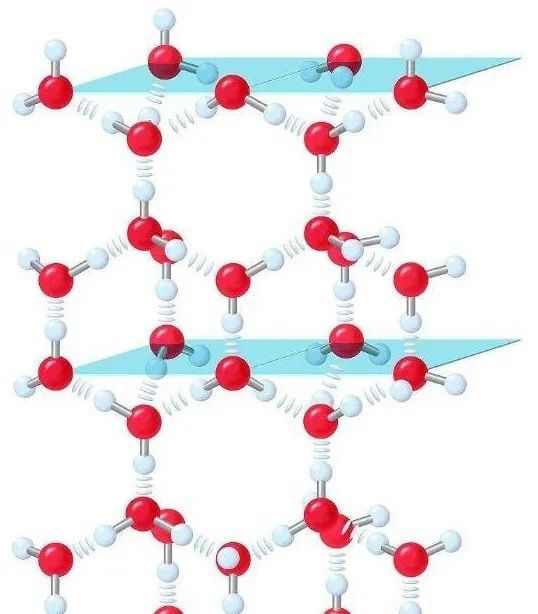
冰的结构
H2O、NH3、HF相互之间也会形成氢键。
(2)氢键也存在于分子内。
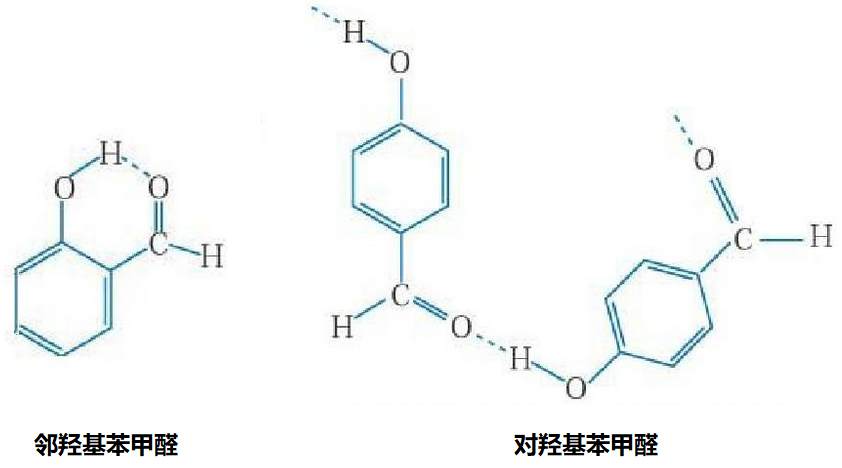
邻羟基苯甲醛因为在分子内形成了氢键,所以在分子间无法形成氢键。而对羟基苯甲醛无法在分子内形成氢键,能在分子间形成氢键。邻羟基苯甲醛的沸点小于对羟基苯甲醛的沸点。
3、溶解性
物质相互溶解存在“相似相溶”的规律。
(1)极性相似相溶
HCl易溶于水,HCl和水都是极性分子。
I2易溶于苯和CCl4,I2、苯和CCl4都是非极性分子。

左侧碘溶于苯,右侧碘溶于CCl4
(2)有氢键的相溶
HF、NH3易溶于水,HF、NH3和水都能形成氢键。
(3)分子结构相似相溶
CH3OH易溶于水,CH3OH和水的结构相似。
三、分子的手性
1、手性:
像左手和右手一样互为镜像,却在三维空间里不能叠合。

手性异构:具有完全相同的组成和原子排列的一对分子,但空间结构上具有手性关系,这种异构互称手性异构。
手性异构体:具有手性异构的一对分子互称为手性异构体。
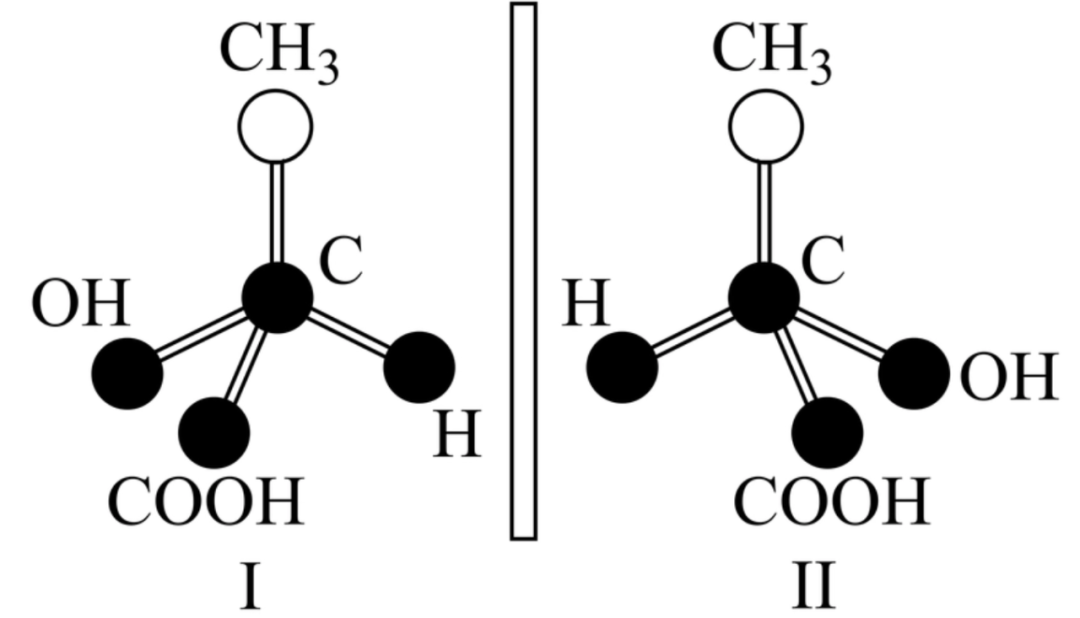
上图中的中心碳原子为手性碳原子。手性碳原子的特征是连结手性碳原子的四个原子或原子团各不相同。
2、研究手性异构的意义:
手性异构体之间的性质不完全相同。
有些药物的某种手性异构体有药效,而另一种没有药效,使用只具有药效的手性异构体可以减少用药量,减少毒副作用,提高药物专一性。
手性合成是当代化学的热点之一。
手性催化

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
绪言 1 、 17 世纪中叶,化学开始走上以 科学实验 为基础的发展...
一、配合物 1 、 CuSO 4 固体是白色的, CuCl 2 固体是棕黄色的,...
一、金属晶体与金属键 1 、固态的金属都是晶体,称为金属晶体...
一、共价键 (弄懂共价键的成键过程,对理解大 л 键和杂化轨...
一、能层与能级 1 、核外电子的分层 核外电子在能量不同的区域...
离子、原子、分子之间通过什么作用力形成宏观物质呢? 有些靠...