
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
有一类问题借助分子的空间结构来考查学生的空间想象能力。如1996年全国高考16题:
描述CH3-CH![]() CH-C
CH-C![]() C-CF3分子结构的下列叙述中正确的是(? )。
C-CF3分子结构的下列叙述中正确的是(? )。
? A.6个碳原子有可能在同一条直线上
B.6个碳原子不可能在同一条直线上
C.6个碳原子有可能在同一个平面上
D.6个碳原子不可能在同一个平面上
答案:B,C。
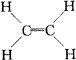
又如1999年第17题:下列有机分子中,所有的原子不可能处于同一平面的是(? )。
A.CH2![]() CH-CN
CH-CN
? B.CH2![]() CH-CH
CH-CH![]() CH2
CH2
C.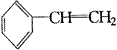 |
D.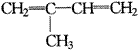 |
仔细分析以上两个问题,至少包含了以下三个方面的基本理论:①鲍林的现代价键理论;②分子光谱理论;③分子的构象理论。下面针对上述问题具体阐述如下。
一、鲍林的现代价键理论
现代价键理论能够解释共价键具有一定的方向性。如氧元素形成两个σ键时成角形,如水分子(图1);H2O2分子结构中,O-H键和O-O键的键角为97°(图2),这是为什么呢?
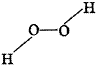 |
|
| 图1 H2O分子 | 图2 H2O2分子 |
由于空间因素的影响:H2O分子两个氢原子间距离较近,排斥力大,从而使键角比H2O2分子的O-H键和O-O键的夹角更大一些。比较H2O和H2O2分子中的夹角可以看出,虽然氧元素在不同的分子中形成的两个σ键的夹角略有变化,但由于各种原子成键的方向性决定了氧元素成键的基本形状。
CH3-CH![]() CH-C
CH-C![]() C-CF3分子中以
C-CF3分子中以
 |
为基本结构, |
该分子可看作是乙烯结构中的两个氢原子被—CH3和—C![]() C—CF3所取代,没有改变乙烯分子的基本形状。因此
C—CF3所取代,没有改变乙烯分子的基本形状。因此
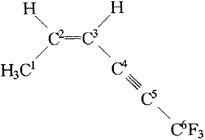 |
中1、2、3、4碳原子共面。同理,
|
|
可看作是H-C |
| 分子中的两个氢原子被 | CH3-CH |
故3、4、5、6四个碳原子共线。根据以上分析,6个碳原子有可能在同一个平面内,而不在同一条直线上。
二、分子光谱理论
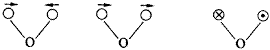
在1996年高考试题16题和1997年高考17题中为什么在题中都加上“可能”或“不可能”的叙述呢?有些同学认为6个碳原子一定在同一平面内,但为什么还说有可能在同一平面内呢?我们知道,对于分子来讲,它吸收某一特定频率的辐射从而引起分子转动或振动能级的变化,或使分子激发到较高的能级,产生特征分子光谱。分子光谱可分为三类:①转动光谱;②振动光谱;③电子光谱。我在这里只阐述与该问题有关的分子振动光谱。它是红外光谱的一种,是由于分子中原子或原子团的振动而引起的。原子间沿着键轴的伸长或缩短进行伸缩振动,组成化学键的原子、离子沿键轴而上下左右弯曲等于进行弯曲振动。伸缩振动引起键长的变化,弯曲振动引起键角的变化。伸缩振动可分为对称伸缩和不对称伸缩振动两种,如图3所示。
| 图3 对称伸缩振动 | 不对称伸缩振动 |
弯曲振动可分为面内弯曲振动和面外弯曲振动两种。面内弯曲振动又分为剪式振动和平面摇摆振动;面外弯曲振动又分为非平面摇摆和扭曲振动,如图4所示。
 |
|
| 图4 面内弯曲振动 | 面外弯曲振动 |
根据以上理论,就甲烷分子而言,由于伸缩振动使得两个C—H键的长度不是任何时刻都相等,由于弯曲振动使得C—H键夹角不是在任何一个时刻都为109.28°。因此,在这个意义上,我们所说的键长和键角是一个平均概念,是一段时间内的平均值。对于
| CH3-CH |
分子而言,存在着原子或原子团的振动, |
因此1、2、3、4各碳原子不是在任何一个时刻都在同一平面内,3、4、5、6各碳原子不是在任何一个时刻都在同一直线上,而仅仅是1、2、3、4各碳原子有可能在同一平面内,3、4、5、6各碳原子有可能在同一直线上,因此1、2、3、4、5、6各碳原子有可能在同一平面内。
三、构象理论
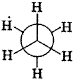
所谓构象是指在有一定构造的分子通过单键的旋转,形成各原子或原子团的空间排布。构造式相同的化合物有许多构象。如乙烷的许多构象中有两个极限构象。一种是交叉式或反叠式构象,另一种是重叠式或叫顺叠式构象,如图5所示。
 |
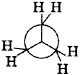 |
| 图5?交叉式 | 重叠式 |
| 说明: |
在交叉式中的两组氢原子处于交错位置,三对氢原子的距离最远,能量最低,构象最稳定;在重叠式中三对氢原子距离最近,能量最高,构象最不稳定。实验证明由交叉式转变为重叠式必须吸收12.5kJ/mol的能量,反之,由重叠式转变为交叉式需要释放出12.5kJ/mol?的能量。因此乙烷构象式由一系列能量态不同的构象所构成,但是各构象之间的转化能量很低。因此,在室温时乙烷分子中的C-C键能迅速地旋转,不能分离出乙烷的某一构象。因此,从理论上讲分子的构象是无数的。
| 在CH3-CH |
分子中由于单键旋转而引起的构象是 |
无数的,但无论如何旋转,1、2、3、4、5、6各碳原子仍然在
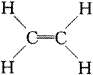 |
所确定的平面内。 |
如果我们把问题深入地考虑,该分子最多将有几个原子处于同一平面内?
通过以上的分析,1、2、3、4、5、6各碳原子有可能在同一平面内。由于—CH3旋转可使最少有1个氢原子在该平面内。—CF3的旋转,最多有一个F原子在该平面内。因此,最多有10个原子在同一平面内。
??我们再分析1997年高考试题第17题。
|
A.
|
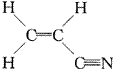 |
可看作是-C |
取代乙烯中的氢原子。根据价键理论,基本不改变各原子的相对位置关系。因此,C-H键和C![]() C键夹角仍然约为120°,由原子的振动从平均结果来看,处于同一平面上,因此各原子可能处于同一平面内。
C键夹角仍然约为120°,由原子的振动从平均结果来看,处于同一平面上,因此各原子可能处于同一平面内。
|
C.
|
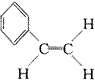 |
苯环中各原子的振动确定一个平面, |
该分子可看作是苯分子中的一个氢原子被-CH![]() CH2所取代,苯环中的一个碳原子与-CH
CH2所取代,苯环中的一个碳原子与-CH![]() CH2的振动确定一个平面,因此该分子中的原子处于
CH2的振动确定一个平面,因此该分子中的原子处于
| 和 | 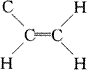 |
确定的两个平面之中,但由于在结构
 |
中的C-C键的旋转, |
使两个平面可能重合。B项的分析方法与C项的分析方法类似。
|
D.
|
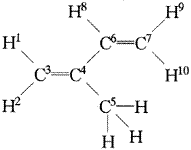 |
分子中1、2、3、4、5、6各原子的振动 |

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
在高考中考查: 近几年新高考中最早出现非苯环芳香烃相关考查...
立体结构差异 椅式环己烷结构中,碳原子构成的环近似于一个三...
电子效应,在大多数反应中,由于取代基(与氢原子相比)倾向...
一、芳香烃的定义 具有芳香性的烃称为芳香烃,一般是指分子中...
一、一些特殊反应 1、醇解反应: 卤代烃与醇钠的醇溶液反应,...
烷的取代反应主要是自由基反应。比如: Cl 2 →2Cl· CH 4 →CH 3...