
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
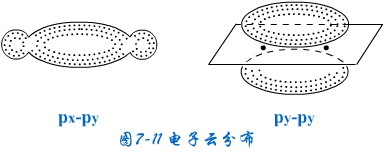
原子轨道按“肩并肩”的方式发生轨道重叠,轨道重叠部分对通过键轴的一个平面具有镜面反对称,这种共价键称为π键。除p-p轨道可以重叠形成π键外,p-d,d-d轨道重叠也可以形成π键。
由于σ键对键轴呈圆柱形对称,所以电子云在两核之间密集,π键对键轴平面呈镜面反对称,电子云在键轴上下密集(见图7-11)。σ键是两个成键原子轨道沿值最大的方向重叠而成,满足轨道最大重叠原理,两核间浓密的电子云将两个成键原子核强烈地吸引在一起,所以σ键的键能大,稳定性高。形成 π键时轨道不可能满足最大重叠原理,只采用“肩并肩”的方式重叠,使得在键轴平面上的电子云密度为零,只有通过键轴平面上、下两块电子云将两核吸在一起,这二块π键电子云离核较远,一般情况是π键的稳定性小,π电子活泼,容易参与化学反应。
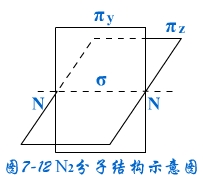
两个原子可以形成多重键,其中必定先形成一个σ键,其余为π键。例如N2分子有三个键,一个σ键,两个π键,.示意如图7-12。
σ键由2px-2px轨道形成;π键分别2py-2py;2pz-2pz由轨道形成。p轨道的方向决定了N2分子中三个键互相垂直。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
补充:...
手性分子不一定含有手性碳原子。 判断分子是否具有手性的黄金...
冠醚是一类大环多醚化合物,其分子结构呈环状,环上均匀分布...
在高考备考化学试卷里,经常会遇到含钯的催化剂。本文将就钯...
在离子晶体中存在离子极化现象,使得离子键带有一定共价键的...
【情境】:你注意到我们每天都离不开的水有什么反常之处吗?...