
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
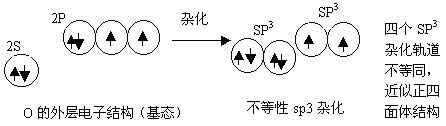
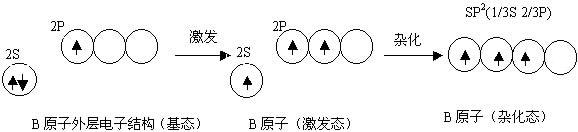
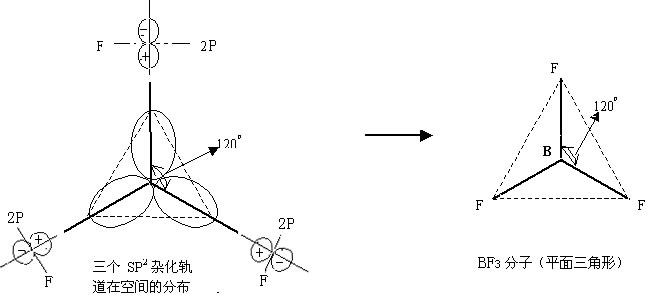
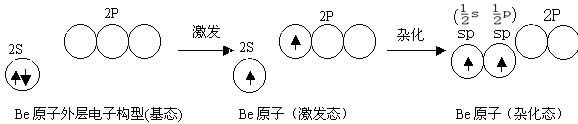
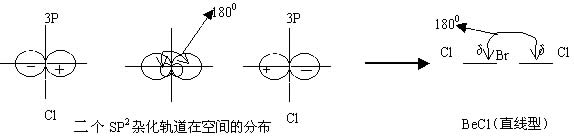
一、sp3 杂化——分子的空间构型为(正)四面体
以CH4为例
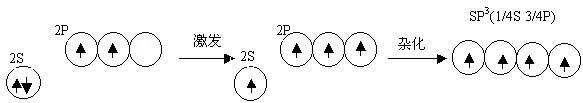
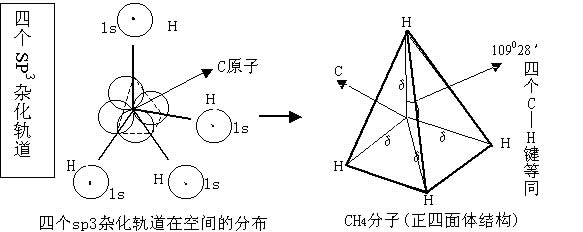
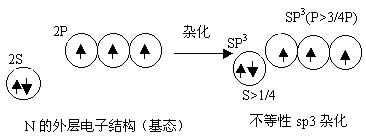 | 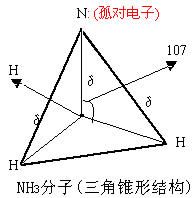 |

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
说明:本文介绍了化学键的本质及其分类。文章详细介绍了价键...
手性碳原子 是指人们将连有四个不同基团的碳原子形象地称为手...
补充:...
手性分子不一定含有手性碳原子。 判断分子是否具有手性的黄金...
冠醚是一类大环多醚化合物,其分子结构呈环状,环上均匀分布...
在高考备考化学试卷里,经常会遇到含钯的催化剂。本文将就钯...