
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
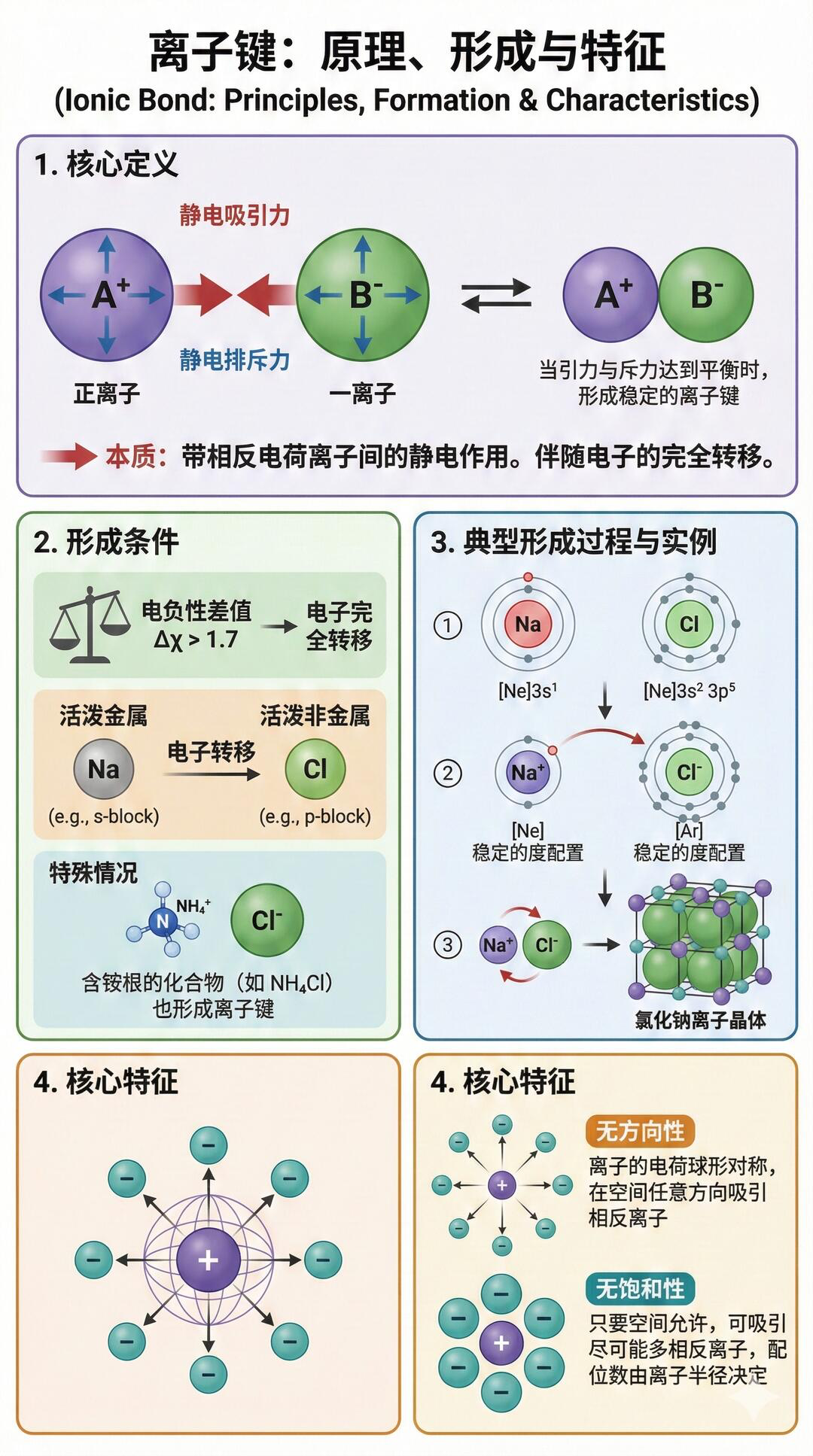
一、离子键:阴阳离子的“强制锁死”
本质:电子转移后,阴阳离子靠静电作用结合(不是共用电子!)
特点:无方向性、无饱和性,键能较强
例子:NaCl(钠丢电子成Na⁺,氯得电子成Cl⁻,正负相吸锁死)、MgO
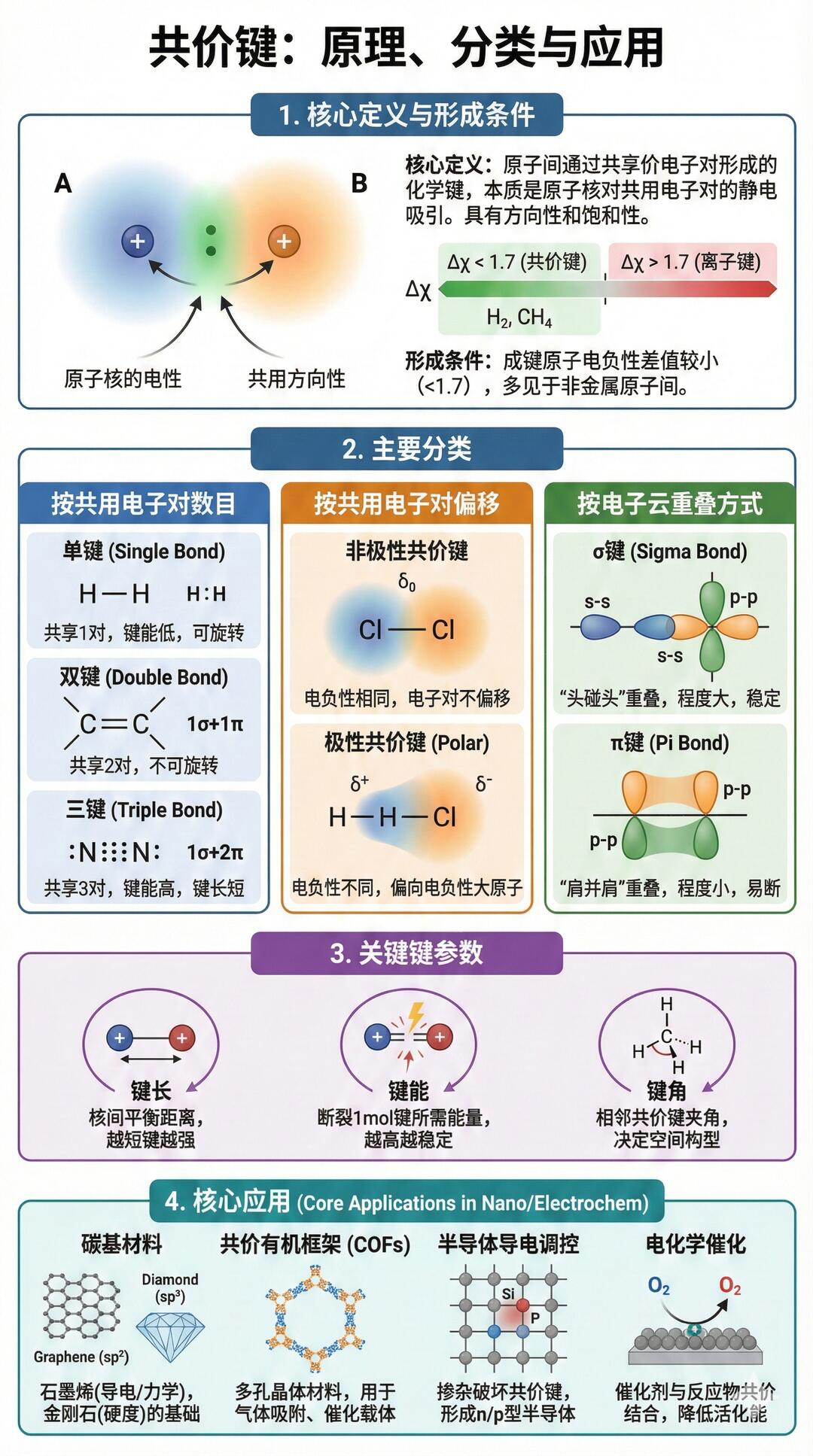
二、共价键:电子的“共享小组”
本质:原子间通过共用电子对形成的相互作用,最常见的化学键之一
特点:有方向性、有饱和性(共用电子对数量有限)
分类:极性键(如HCl,电子对偏向氯)、非极性键(如O₂,电子对均匀分布)
例子:H₂O、CO₂、CH₄
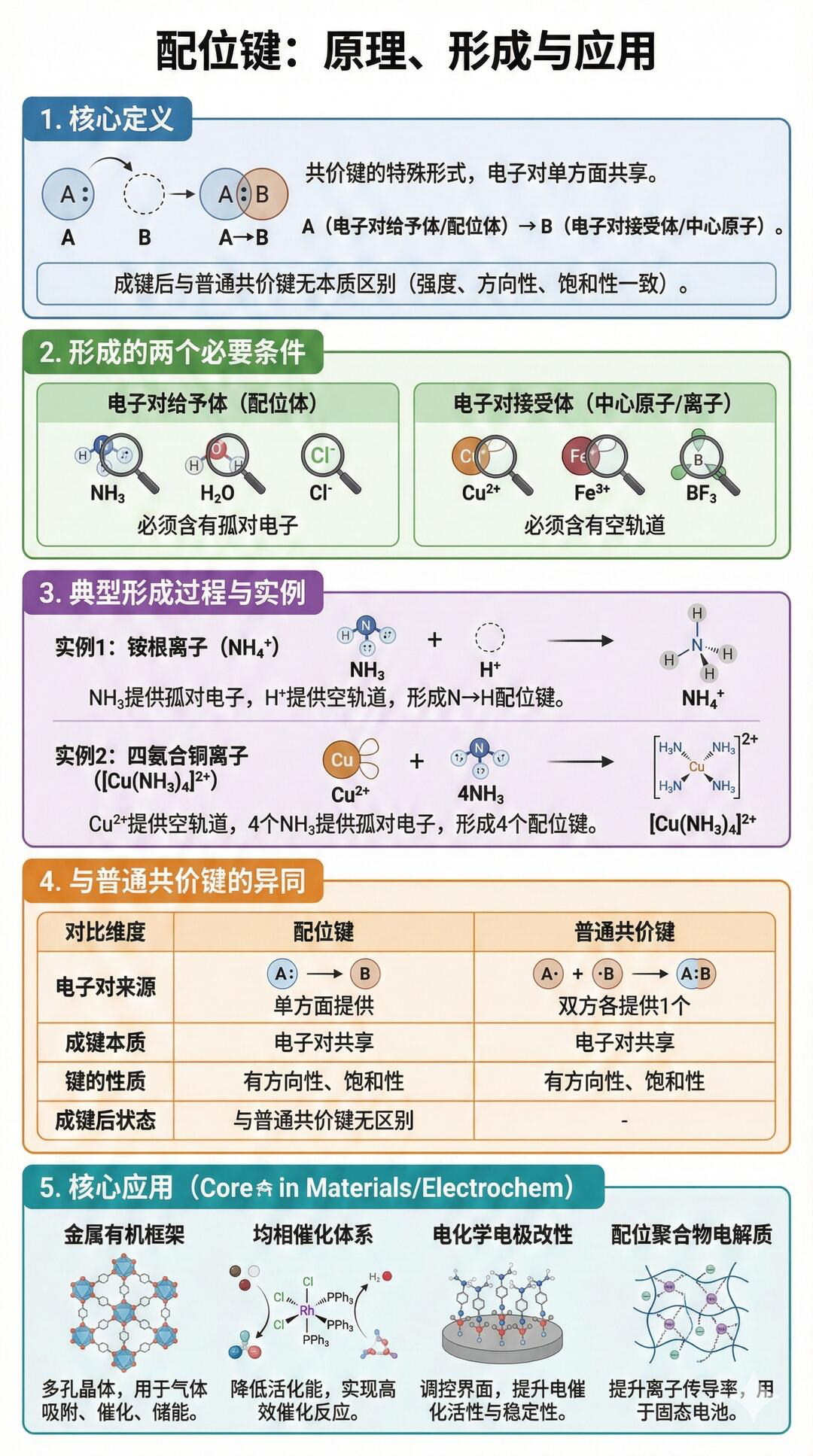
三、配位键:电子的“单方面赠与”
本质:特殊共价键!由一个原子提供孤电子对,另一个原子提供空轨道,双方共用(相当于“一方请客,双方吃饭”)
特点:形成后和普通共价键无区别,仅形成方式不同
例子:NH₄⁺(N提供孤对电子,H⁺提供空轨道)、[Cu(NH₃)₄]²⁺
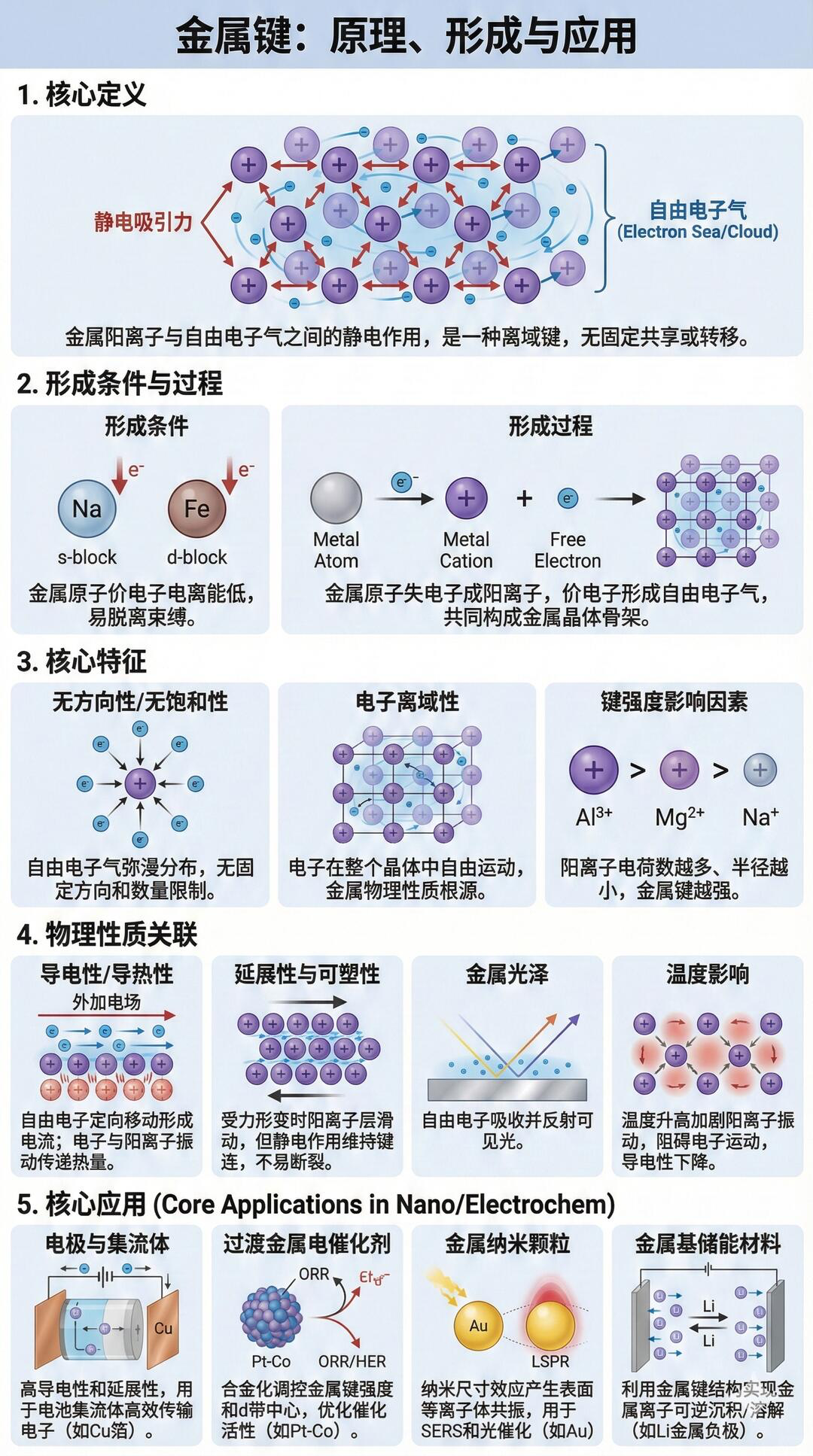
四、金属键:金属原子的“电子海”
本质:金属阳离子与自由电子之间的静电作用(电子自由流动,不专属某个原子)
特点:无方向性、无饱和性,决定金属的导电性、导热性、延展性
例子:所有金属(Fe、Cu、Al等)
五、氢键:不是化学键!是“分子间暧昧”
划重点:氢键是分子间/分子内的弱相互作用,不属于化学键!强度介于范德华力和化学键之间
形成条件:含H与电负性大、半径小的原子(F、O、N)相连,再与另一个F/O/N作用
影响:使水的沸点升高、冰的密度小于水,是DNA双螺旋结构稳定的关键

六、π-π堆积:芳香环的“面对面贴贴”
本质:两个或多个芳香环(含离域Π键)之间的弱相互作用,靠Π电子云重叠吸引
特点:常见于芳香族化合物,影响分子结晶、生物大分子构象
例子:苯分子晶体、DNA中碱基对的堆积作用

七、阳离子-π相互作用:离子与芳香环的“单向吸引”
本质:阳离子(如金属离子、NH₄⁺)与芳香环的离域Π电子云之间的静电吸引
特点:弱相互作用,在生物体系、超分子化学中很重要
例子:酶与底物的结合、蛋白质与金属离子的相互作用


 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
说明:本文介绍了化学键的本质及其分类。文章详细介绍了价键...
手性碳原子 是指人们将连有四个不同基团的碳原子形象地称为手...
补充:...
手性分子不一定含有手性碳原子。 判断分子是否具有手性的黄金...
冠醚是一类大环多醚化合物,其分子结构呈环状,环上均匀分布...
在高考备考化学试卷里,经常会遇到含钯的催化剂。本文将就钯...