
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
共价键的成键特征是饱和性和方向性,共价键的饱和性是指原子的价电子数都是有限的,共价键依赖价电子形成电子对,成键数目就是有限的,比如CH4、CH3Cl都已用完了C的价电子及其价层轨道,不能形成第五个共价键数目有限就是共价键的饱和性。ⅠA、ⅡA元素主要形成离子键,从ⅢA开始容易形成共价键,依据共价键的饱和性ⅢA——ⅦA短周期主族元素的形成的化合物中价数目=键数目,常见的最高正价和最低负价的化合物中成键特征如下。
ⅢA:B和Al的缺电子性形成一个配位键共形成四个共价键。
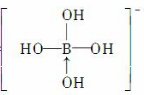
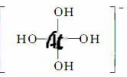
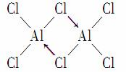
ⅣA最低负价-4,最高正价+4
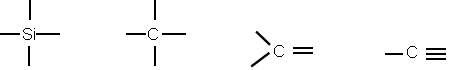
ⅤA最低负价-3最高正价+5

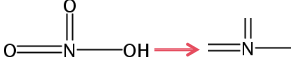
ⅥA最低负价-2最高正价+6


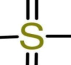
卤族元素最低负价-1成键特征-X,最高正价+7考查较少
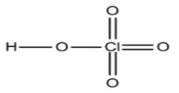
氢元素的成键特征也是-H
例1【2023年辽宁卷】某种镁盐具有良好的电化学性能,其阴离子结构如下图所示。W、X、Y、Z、Q是核电荷数依次增大的短周期元素,W、Y原子序数之和等于Z.Y原子价电子数是Q原子价电子数的2倍。下列说法错误的是()
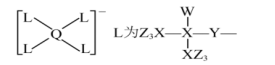
A.W与X的化合物为极性分子
B.第一电离能Z>Y>X
C.Q的氧化物是两性氧化物
D.该阴离子中含有配位键
解析:答案为A。根据化合物中原子的成键特点分析:W的原子序数最小,且形成1个共价键,则W为H;X形成4个共价键,则X为C;Y形成2个共价键,则Y为O或S;Z形成1个共价键,且原子序数等于W和Y的原子序数之和,则Z为F或Cl;Q形成4个共价键后带一个单位的负电荷,且Y原子价电子数是Q原子价电子数的2倍,则Q为Al,结合原子序数关系可知,Y只能为0,Z只能为H与C形成的化合物为烃类,烃类物质的分子中正负电荷中心可能重合,如甲烷,其为非极性分子,A项错误;同周期从左到右,元素的第一电离能呈增大趋势,故第一电离能:,B项正确;既能与强酸反应,也能与强碱反应,属于两性氧化物,C项正确;该阴离子中,中心AI原子形成4个键,其中一个为配位键,D项正确。
例2【2022年湖南卷】科学家合成了一种新的共价化合物(结构如图所示),X、Y、Z、W为原子序数依次增大的短周期元素,W的原子序数等于X与Y的原子序数之和。下列说法错误的是
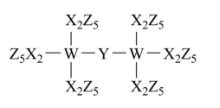
A.原子半径:X>Y>Z。
B.非金属性:Y>X>W
C.Z的单质具有较强的还原性
D.原子序数为82的元素与W位于同一主族
依据成键特征可快速判断X、Y、Z、W分别为碳、氧、氟、硅再利用元素周期律答案为C.
7.(2021·广东真题)一种麻醉剂的分子结构式如图所示。其中,X的原子核只有1个质子;元素Y、Z、W原子序数依次增大,且均位于X的下一周期;元素E的原子比W原子多8个电子。下列说法不正确的是
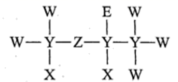
A.XeZ₄是一种强酸
B.非金属性:W>Z>Y
C.原子半径:Y>W>E
D.ZW₂中,Z的化合价为+2价
解析:答案为C。根据X的原子核只有1个质子,可知X为H元素;根据题意知Y、Z、W均为第二周期元素,结合题图中Y形成4个共价键、Z形成2个共价键、W形成1个共价键和原子序数关系可确定Y为C元素、Z为0元素、W为F元素;再结合E的原子比W原子多8个电子,可知E为Cl元素。即HClO4是自然界中酸性最强的含氧酸,A项正确;同周期主族元素,从左到右,非金属性逐渐增强,则非金属性 ,即 ,B项正确;原子半径 ,即 项错误;即 元素为-1价,根据化合价代数和为0,可知0元素为 价,D项正确。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
一、推理方法 1 、利用原子周围的键数推理出原子的最外层电子...
元素推断题是高考考查的热点,这类题往往将元素化合物的知识、...
一:形成8电子稳定结构的元素特点: 当最外层电子数M层小于...
一、高考再现 〔2019全国I卷〕科学家合成出了一种新化合物(如图...
本次大会出现的一些高频词汇涉及了很多化学知识,通过本文带...
离子的半径(以离子半径的单位为10-10m): 1.同种元素原子与离子比...