
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、含氧酸酸性强弱变化规律
若用通式![]() 表示含氧酸,则其酸性强弱与R元素的非金属性及其原子的半径有关。R元素的非金属性越强,则其原子核对核外共用电子对的吸引力越强,
表示含氧酸,则其酸性强弱与R元素的非金属性及其原子的半径有关。R元素的非金属性越强,则其原子核对核外共用电子对的吸引力越强,![]() 间的共用电子对越偏向R原子的一方;R元素原子的半径越小,则
间的共用电子对越偏向R原子的一方;R元素原子的半径越小,则![]() 间的共用电子对也越偏向R原子一方,致使OH间的共用电子对偏向氧原子,则氢氧原子间极化程度增大。在水分子的作用下氢原子能很容易电离成氢离子,即显现酸性,具体归纳为如下三点规律。
间的共用电子对也越偏向R原子一方,致使OH间的共用电子对偏向氧原子,则氢氧原子间极化程度增大。在水分子的作用下氢原子能很容易电离成氢离子,即显现酸性,具体归纳为如下三点规律。
1. 同一周期非金属元素含氧酸从左到右酸性逐渐增强
因为同一周期中,从左到右R元素的非金属性逐渐增强,吸引电子对的能力增强,而R元素的原子半径逐渐减小,也即![]() 间的电子对偏向R一方的程度增大。含氧酸分子中的氢原子的极化程度增大。
间的电子对偏向R一方的程度增大。含氧酸分子中的氢原子的极化程度增大。![]() 键在水分子的作用下电离程度增大。即同一周期酸性逐步增强。
键在水分子的作用下电离程度增大。即同一周期酸性逐步增强。
如:第2周期含氧酸酸性变化规律为:
![]()
第3周期含氧酸酸性变化规律为:
![]()
2. 同一主族元素从上到下含氧酸的酸性逐渐减弱
因为同一主族元素从上到下,R元素的非金属性逐渐减弱,R元素的原子半径从上到下逐渐增大,R原子吸引电子对的能力逐渐减弱。![]() 键的极化程度逐渐减弱。则从上到下含氧酸的酸性逐渐减弱。
键的极化程度逐渐减弱。则从上到下含氧酸的酸性逐渐减弱。
如:第VA族元素的含氧酸的酸性递变规律为:
![]()
第VIIA族元素的含氧酸的酸性递变规律为:
![]()
3. 同一元素不同价态的含氧酸酸性高价强于低价
如:![]() 。
。
因为卤原子的价态由+7价降到+1价,卤原子随价态的降低原子核的正电性减弱,原子核对电子吸引能力逐渐减弱,而半径却因电子偏移程度减小而逐渐增大。两方面的原因都促使卤原子的含氧酸中![]() 键的极化程度逐渐减小。从而不同价态的含氧酸的酸性随价态由高到低而逐渐减弱。但磷的含氧酸例外,如:磷的含氧酸的酸性强弱变化规律为:
键的极化程度逐渐减小。从而不同价态的含氧酸的酸性随价态由高到低而逐渐减弱。但磷的含氧酸例外,如:磷的含氧酸的酸性强弱变化规律为:![]() ,酸性随磷原子价态的升高而减弱。其原因在于磷酸是多元酸,结构与一般的含氧酸不同,一般的含氧酸氢原子都是直接与氧原子相连,而磷的含氧酸中部分氢原子是直接与磷原子相连。它们的结构式如下:
,酸性随磷原子价态的升高而减弱。其原因在于磷酸是多元酸,结构与一般的含氧酸不同,一般的含氧酸氢原子都是直接与氧原子相连,而磷的含氧酸中部分氢原子是直接与磷原子相连。它们的结构式如下:
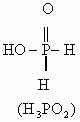
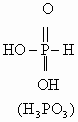
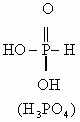
从![]() 到
到![]() 与P直接相连的氢原子数目逐渐减少,而与P直接相连的
与P直接相连的氢原子数目逐渐减少,而与P直接相连的![]() 数目逐渐增多。由于氧原子的电子云密度较大,从而导致
数目逐渐增多。由于氧原子的电子云密度较大,从而导致![]() 到
到![]() 分子中P的正电性减弱。对
分子中P的正电性减弱。对![]() 键的诱导作用减小,
键的诱导作用减小,![]() 键的极化程度减小,因此磷的含氧酸的价态高酸性反而弱。
键的极化程度减小,因此磷的含氧酸的价态高酸性反而弱。
二、无氧酸的酸性强弱变化规律
若用通式![]() 表示无氧酸,则其酸性的强弱主要取决于R对H的束缚力强弱。如果R原子电子云密度大,对氢原子的束缚力强,则其酸性弱。如果R原子的电子云密度小,对氢原子的束缚力弱,则其酸性就强。而R原子的电子云密度与其价态数成正比,与其原子半径成反比。具体归纳如下两点:
表示无氧酸,则其酸性的强弱主要取决于R对H的束缚力强弱。如果R原子电子云密度大,对氢原子的束缚力强,则其酸性弱。如果R原子的电子云密度小,对氢原子的束缚力弱,则其酸性就强。而R原子的电子云密度与其价态数成正比,与其原子半径成反比。具体归纳如下两点:
1. 同周期元素从左到右无氧酸酸性逐渐增强
因为同一周期元素的无氧酸中R原子的价态数从左到右逐渐减小,R原子半径也逐渐减小。但两者比较,价态数影响要比半径变化所起的作用大,因而对氢原子的束缚力逐渐减小,相应的酸性依次增强。如:第2、3、4、5周期的无氧酸的变化规律为:
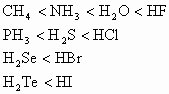
2. 同主族元素的无氧酸酸性从上到下逐渐增强
因为这些无氧酸中,与氢原子相连的非金属元素原子价态数相等,而原子半径从上到下逐渐增大,则非金属元素原子对氢原子的束缚力逐渐减小。因而同一主族非金属元素的无氧酸酸性从上到下逐渐增强。
如:![]()
![]()
总之,把无机酸分为含氧酸、无氧酸,从分子内部的作用力,能更好地解释无机酸的强弱变化规律,为学生学好无机酸强弱变化规律起到高屋建瓴的作用。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
一、推理方法 1 、利用原子周围的键数推理出原子的最外层电子...
元素推断题是高考考查的热点,这类题往往将元素化合物的知识、...
一:形成8电子稳定结构的元素特点: 当最外层电子数M层小于...
一、高考再现 〔2019全国I卷〕科学家合成出了一种新化合物(如图...
本次大会出现的一些高频词汇涉及了很多化学知识,通过本文带...
离子的半径(以离子半径的单位为10-10m): 1.同种元素原子与离子比...