
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
2023年湖南卷16题的第(5)问(见图一),第(5)问“引发剂C6H5CH2Cl、C6H5CH2Br、C6H5CH2I中活性最高的是_______。”网络上比较流行的一种答案和解析(见图二):“电负性Cl>Br>I,则极性C—Cl键>C—Br键>C—I键,则C6H5CH2Cl更易生成自由基,即活性最高的是C6H5CH2Cl”,这是错误答案,也是学生和教学新手常犯的一个错误。关于“反应活性”,我还是觉得有必要和大家交流一下,怕整成连续剧,标题也换了一下。

图一

图二
有机反应的本质,就是化学键的断裂与形成。所谓“反应活性高”,我理解就是容易反应。因此在有机反应中,键能越小,键越容易断,就越容易反应,反应活性也就越高。这一点,在邢其毅《基础有机化学》(第四版)上册第241-242页(见图三)也得到佐证。由于原子半径Cl<Br<I,键长:C—Cl<C—Br<C—I,则键能:C—Cl>C—Br>C—I,故C6H5CH2I中的C—I键更容易断开,生成自由基,即活性最高的是C6H5CH2I。故湖南卷16题第(5)题的答案应为C6H5CH2I。

图三(来源于邢其毅《基础有机化学》(第四版)上册第241-242页)
按照网络上比较流行的那种错误答案和解析的意思,他应当是表达了一个观点:键的极性越大,越容易断键,反应活性越大。
我不知道大家是不是也曾有过这个认识,但是学生确实很容易形成这个认知,所以这个错误在学生中也很普遍。究其根源,可能和我们的教学有关。我校学生使用的是鲁科版教材,在选择性必修三模块的课本中不止一次提到:极性键是反应的活性部位,并根据键的极性预测有机物的性质(见图四和图五)。在比较乙醇(C2H5OH)、水和苯酚(C6H5OH)三者羟基氢的活性时,由于苯环的吸电子效应,使得苯酚分子中羟基的共用电子对进一步偏向电负性大的氧原子,即O—H键的极性增大,比水中的O—H键更容易断裂;由于烷烃基的推电子效应,使得乙醇分子中羟基的共用电子对偏向氧原子的程度小一些,即O—H键的极性减小,没有水中的O—H键容易断裂。这一点,是可以通过三者分别和金属钠反应的剧烈程度得以证实的。由此得出结论:键的极性越大,反应活性越高,越容易断键。

图四
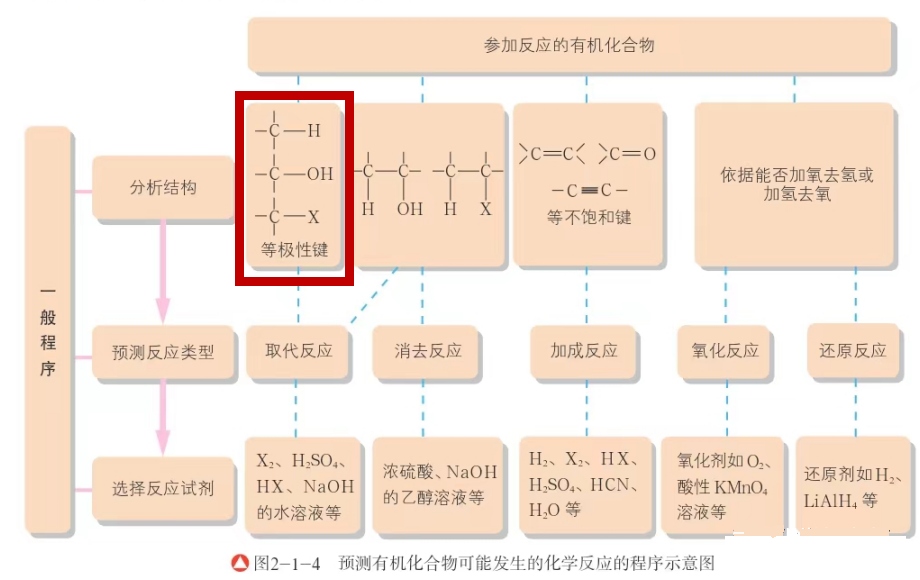
图五
那么这个结论能不能推广? 比如说,用来比较HCl和HF的酸性强弱。如果按照这个结论,电负性:F>Cl,则极性:H—F键>H—Cl键,则H—F键比H—Cl键更容易断裂,故酸性:HF>HCl。众所周知,HF是弱酸,而HCl强酸。很显然,从极性大小角度判断得出的结论与客观事实不符。可见,“键的极性越大,反应活性越高,越容易断键”这个特定条件下结论是不能随意推广的。
影响反应活性的因素很多,如键能、电负性、邻近基团的影响(空间位阻效应、诱导效应、共轭效应等)和所用试剂等等。当然主要因素还是键能,只有当键能大小相同或相近时,极性大的键电子云分布更不均匀,在反应中更容易断键,从而反应活性更高。
当键能差异较大时,还套用上述特定条件下的结论时就会出问题。因此,教学中不要忽略“键能大小相同或相近”这一特定条件,暗示学生“键的极性越大,反应活性越高,越容易断键”,更不要去强化这一结论。
共价键的断裂主要有两种方式:均裂和异裂。
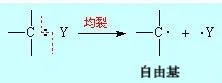
(1)均裂是指在有机反应中,键均等地分裂成两个中性碎片过程。原来成键的两个原子,均裂之后各带有一个未成对的电子,带有单电子的原子或原子团称作自由基或游离基,如下式所示:
自由基机理通常由均裂引发,均裂的特点是该化学键对应两原子电负性区别不大,如
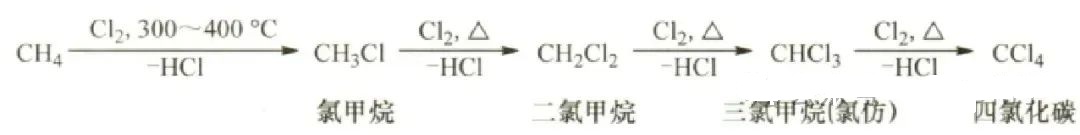
1. 碳氢键
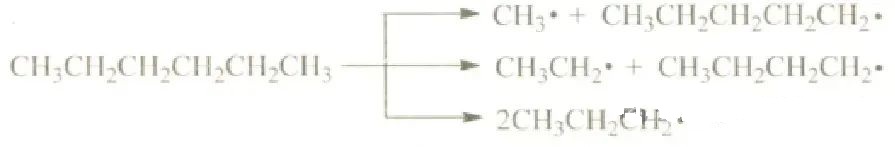
2.碳碳键
3.单质
均裂即化学键均匀断裂,两个原子各得一个电子,形成自由基!
(2)异裂是指在有机反应中键非均等地分裂成两个带相反电荷的碎片过程。即原来成键的两个原子,异裂之后,一个带正电荷,另一个带负电荷,如下式所示:
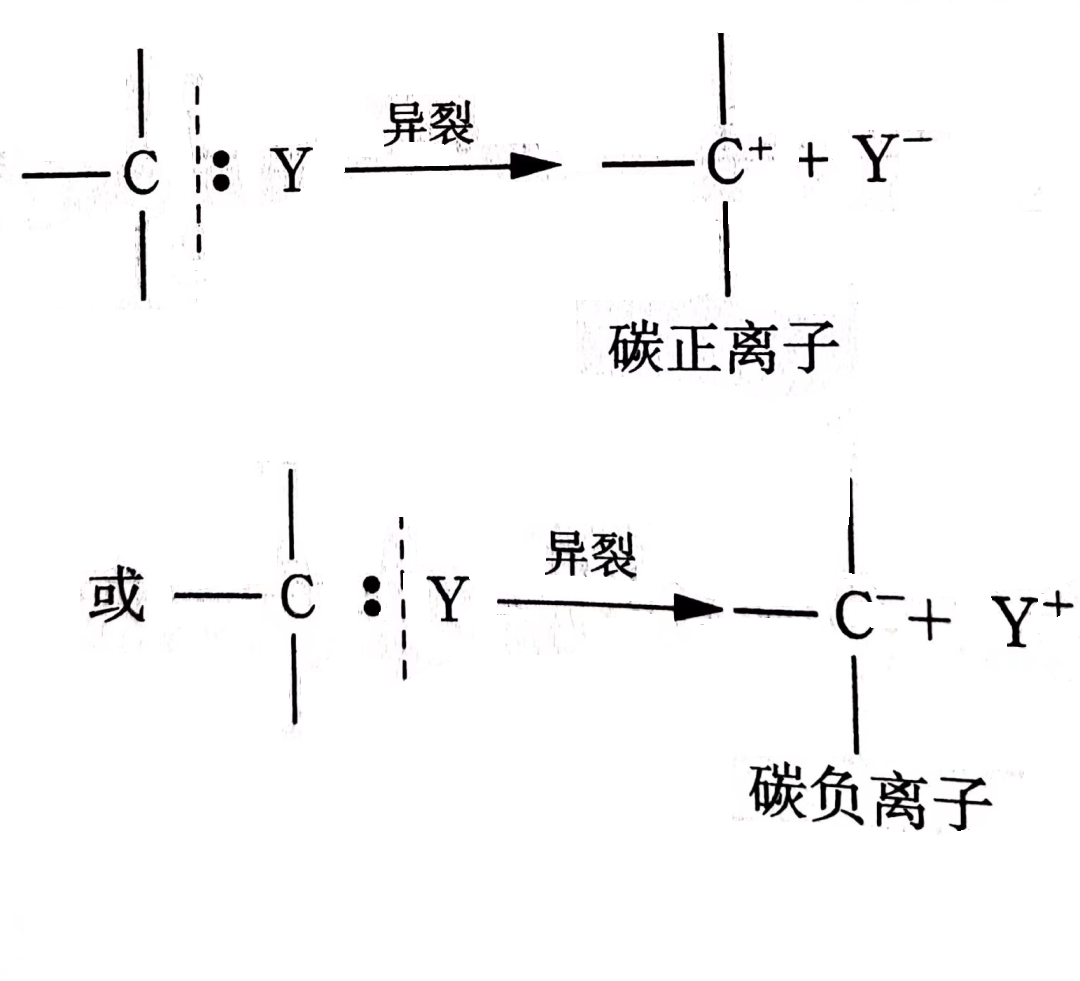
离子型机理通常由异裂引发,异裂的特点是该化学键对应两原子电负性区别较大,通式如

异裂即电子很容易偏向某一原子,化学键不均匀断裂,其中一个原子得到另一个原子的电子形成负离子,另一原子失去电子形成正离子
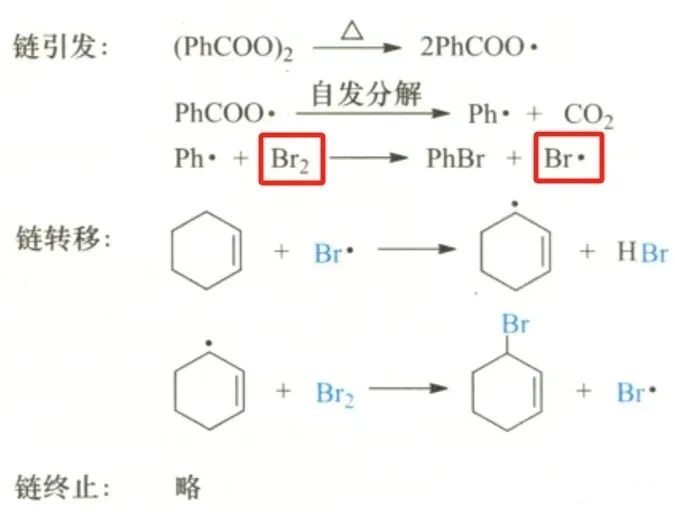
关于离子型机理和自由基机理的竞争:
上文提到,单质如溴,因溴溴键电子分布均匀,故容易发生均裂

但溴单质同样可发生异裂,如
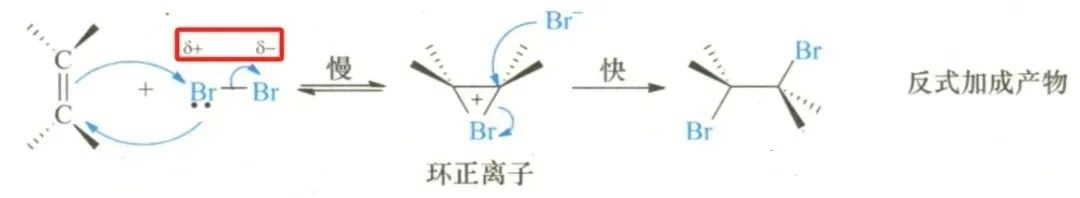
因为原本中性的溴单质在反应体系中被极化从而带电,极化的因素可来自溶剂(偶极溶剂促进极化),也可来自另一分子溴单质或体系中其他化合物(路易斯酸等)。——来自Carry有机画学
从共价键的两种断裂方式不难看出,键的极性越大,越有利于异裂,而键的极性越小,越有利于均裂。再回到湖南卷16题第(5)问的情境,中间过程中关键一步,是要生成苄自由基(C6H5CH2·)的。很显然,选择C6H5CH2I作引发剂,C—I键极性小一些,有利于均裂,更容易产生自由基C6H5CH2·。从这个角度上来说,选择C6H5CH2I作引发剂更为合适。
小结:
羟基O-H键“牢固”、叔碳C-H键“不牢固”均是其自身的“固有性质”,属于热力学性质;O-H键氢“容易被攫取”,C-H键氢“不容易被攫取”是反应的“动态过程”,属于动力学性质。
二者键能差异如图3:
O-H键可视为粗木头,键能高、“牢固”,所以难均裂;
C-H键可视为相对较细的绳子,键能低,“不牢固”,所以易均裂。
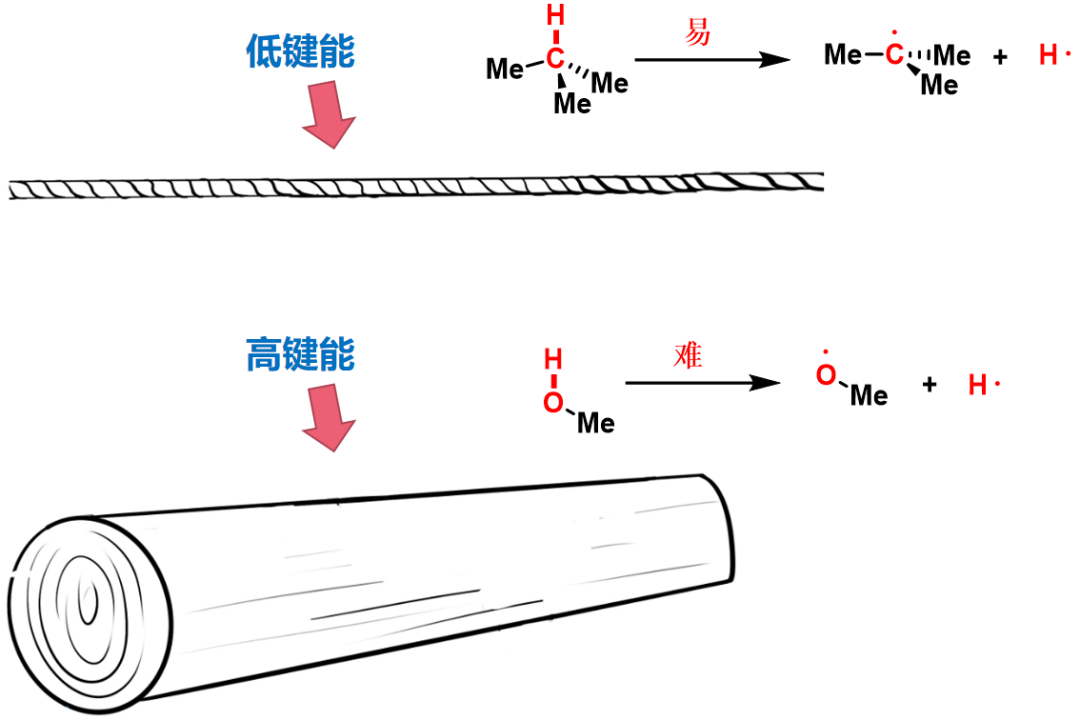
图3:细绳子和粗木头(低键能C-H键和高键能O-H键)
二者异裂活性区别如
图4:O-H键虽键能高,但可借助外部试剂(溶剂、碱等)引发异裂;
图5:C-H键虽键能低,但无合适的外部试剂可供异裂。
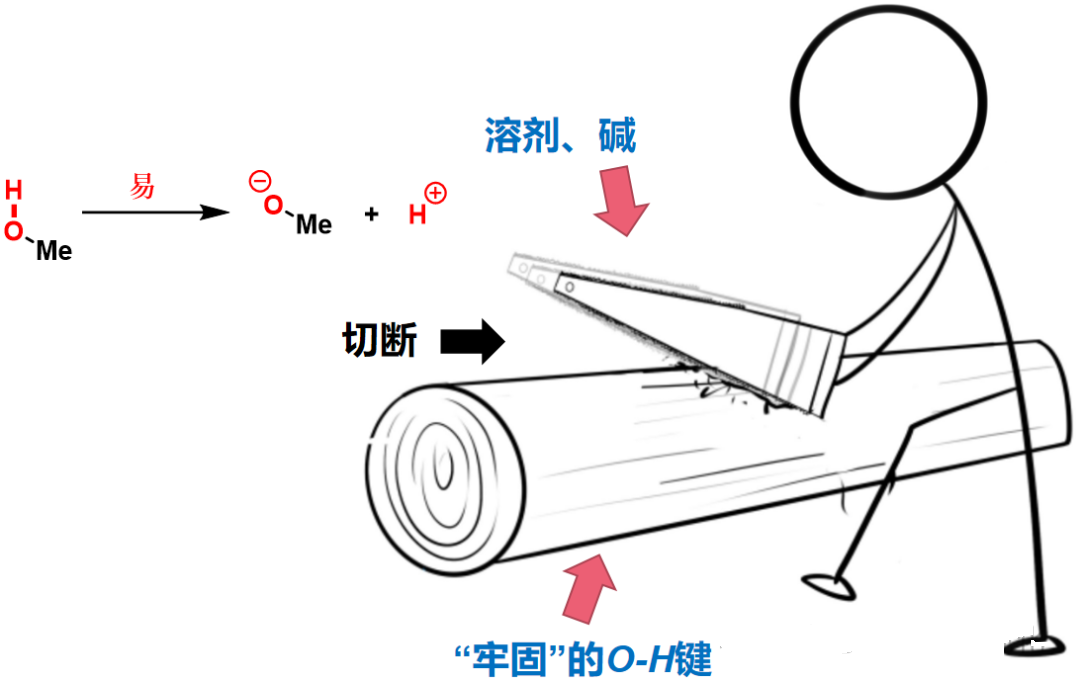
图4:锯断粗木头(低异裂能O-H键)
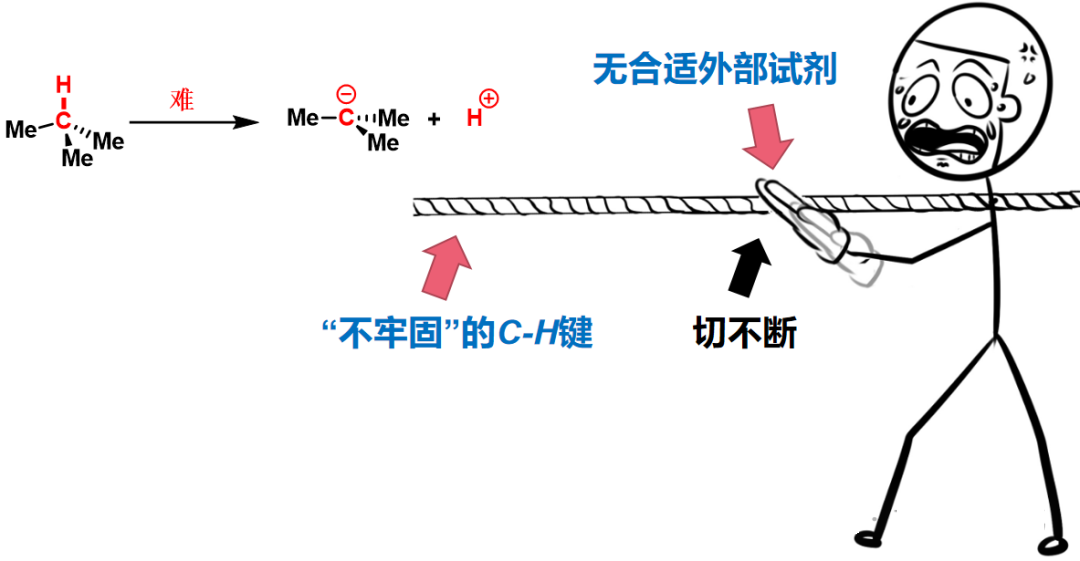
图5:无法切断细绳子(高异裂能C-H键)
虽然只是根细绳子,但如果没有合适的工具,也是很难切断的。——来自机理可视化!

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
冠醚是一类大环多醚化合物,其分子结构呈环状,环上均匀分布...
在高考备考化学试卷里,经常会遇到含钯的催化剂。本文将就钯...
在离子晶体中存在离子极化现象,使得离子键带有一定共价键的...
【情境】:你注意到我们每天都离不开的水有什么反常之处吗?...
氢键的大小(强度)可以通过多种因素来比较,这些因素包括氢键...
...