
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
溶液的酸碱性对氧化还原反应具有显著且多方面的影响,主要体现在以下几个方面:
一、影响氧化剂或还原剂的氧化/还原能力
许多氧化还原物质的电极电势(即氧化还原能力)依赖于 H⁺ 或 OH⁻ 浓度,这可通过 能斯特方程(Nernst Equation) 定量描述:
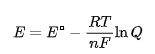
当反应中涉及 H⁺ 或 OH⁻ 时,pH 会直接影响电极电势 E
典型例子:
1. 高锰酸钾(KMnO₄)在不同 pH 下的还原产物不同:
结论:酸性越强,MnO₄⁻ 的氧化能力越强。
强酸性条件(如 H₂SO₄):

→ 氧化性强,产物为无色 Mn²⁺。
中性或弱碱性条件:
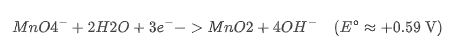
→ 氧化性减弱,生成棕色 MnO₂ 沉淀。
强碱性条件(熔融或浓碱):可生成绿色的 MnO42-锰酸根)。
2. 重铬酸钾(K₂Cr₂O₇)仅在酸性条件下是强氧化剂:
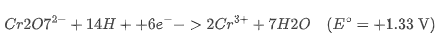
在碱性环境中,Cr(VI) 以 CrO₄²⁻ 形式存在,几乎无氧化性。
二、改变反应的方向或能否发生
某些氧化还原反应只在特定 pH 范围内自发进行。
例子:H₂O₂ 的歧化反应
酸性或中性条件:H₂O₂ 相对稳定。
碱性条件:迅速歧化:2H₂O₂ -> 2H₂O + O₂
OH⁻ 催化了该反应,使其自发加速。
例子:Fe²⁺ 与 O₂ 的反应
在酸性溶液中,Fe²⁺ 可较稳定存在。
在中性或碱性溶液中,Fe²⁺ 易被空气中 O₂ 氧化为 Fe³⁺,并生成 Fe(OH)₃ 沉淀:

碱性环境不仅促进氧化,还通过沉淀移除产物,推动反应向右。
三、影响反应的产物种类或稳定性
酸碱性可决定中间产物是否稳定,从而改变最终产物。
例子:氯气(Cl₂)与碱的反应
冷稀碱液(如 NaOH):
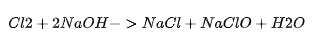
生成次氯酸盐(ClO⁻)。
热浓碱液:
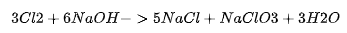
生成氯酸盐(ClO₃⁻)。
若在酸性条件下,ClO⁻ 会迅速歧化或与 Cl⁻ 反应重新生成 Cl₂。
四、影响电极电势的定量关系
以半反应:

其能斯特方程为:

可见:[H⁺] 每降低 10 倍(pH 升高 1),E 下降约 0.094 V。
→ pH 升高 → 氧化能力急剧下降。
五、在高考题中的呈现
溶液酸碱性对氧化还原反应的影响是一个高频、高区分度的考点,常以选择题、实验题、工艺流程题或原理综合题的形式出现。命题注重真实情境、证据推理与模型认知,强调学生对反应条件的控制意识。
以下结合近年典型高考真题,分类解析其呈现方式与考查要点:
1、选择题:判断产物、反应可行性或离子共存
例1:2023年全国乙卷·第10题(节选)
在酸性溶液中,K₂Cr₂O₇ 可将 Fe²⁺ 氧化为 Fe³⁺,自身被还原为 Cr³⁺。下列说法正确的是:
A. 该反应中氧化剂与还原剂物质的量之比为 1:6
B. 可用盐酸酸化反应体系
C. Cr³⁺ 在碱性溶液中可形成 Cr(OH)₃ 沉淀
D. ……
考查点:
配平氧化还原反应(Cr₂O₇²⁻ + 6Fe²⁺ + 14H⁺ → 2Cr³⁺ + 6Fe³⁺ + 7H₂O)→ A 正确;
酸化不能用 HCl(Cl⁻ 会被 Cr₂O₇²⁻ 氧化)→ B 错误;
Cr³⁺ 的沉淀行为与 pH 相关 → C 正确(但需看选项组合)。
核心陷阱:酸化试剂的选择——必须用非还原性酸(如 H₂SO₄),禁用 HCl、HI。
例2:2021年湖南卷·第7题
下列离子在指定溶液中能大量共存的是:
A. 酸性溶液中:MnO₄⁻、Cl⁻、Fe²⁺
B. 碱性溶液中:ClO⁻、I⁻、K⁺
C. 中性溶液中:Fe³⁺、NO₃⁻、SO₄²⁻
D. ……
解析:
A:酸性下 MnO₄⁻ 会氧化 Cl⁻ 和 Fe²⁺ → 不能共存;
B:碱性下 ClO⁻ 仍可缓慢氧化 I⁻ → 不能共存;
C:Fe³⁺ 在中性水中水解生成 Fe(OH)₃ 沉淀 → 不能大量存在。
考点:pH 对氧化剂/还原剂稳定性及离子水解的双重影响。
2、实验题:控制反应条件,解释现象
例3:2022年全国甲卷·第27题(节选)
实验室用 Na₂S₂O₃ 溶液滴定 I₂ 溶液(碘量法)。(1)该滴定需在中性或弱酸性条件下进行,不能在碱性或强酸性条件下进行,原因是______。
标准答案:
强酸性: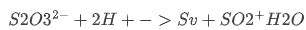 ,硫代硫酸根分解;
,硫代硫酸根分解;
碱性: ,碘发生歧化,消耗量不准。
,碘发生歧化,消耗量不准。
能力要求:能从物质在不同 pH 下的稳定性角度解释实验条件。
3、工艺流程题:调控 pH 优化氧化还原过程
例4:2023年山东卷·第17题(湿法冶金)
从含钒矿石中提取 V₂O₅ 的流程中,有一步用 NaClO₃ 在酸性条件下将 VO²⁺ 氧化为 VO₂⁺。(2)写出该氧化反应的离子方程式。(3)若溶液 pH 过高,会导致氧化不完全,解释原因。
参考答案:
(2) 需配平)
需配平)
(3)pH 过高 → [H⁺] 降低 → 氧化剂 ClO₃⁻ 的氧化能力减弱(能斯特方程),反应速率慢且不完全。
命题逻辑:pH 是工艺控制的关键参数,影响反应效率与产物纯度。
4、原理综合题:结合电极电势或能斯特方程(新高考趋势)
例5:2024年湖北卷·第15题(模拟题风格)
已知半反应: 。当 pH = 3 时,若 [MnO₄⁻] = [Mn²⁺] = 1 mol/L,则该电对的实际电极电势约为(lg2≈0.3):
。当 pH = 3 时,若 [MnO₄⁻] = [Mn²⁺] = 1 mol/L,则该电对的实际电极电势约为(lg2≈0.3):
A. 1.23 V B. 1.33 V C. 1.42 V D. 1.51 V
解析
(能斯特方程):

趋势:新高考逐步引入定量分析 pH 对电极电势的影响,体现“证据推理”素养。
5、高频命题角度总结
考查维度 | 高考常见设问方式 |
|---|---|
产物判断 | “在酸性/碱性条件下,X 被 Y 氧化的产物是?” |
条件控制 | “为何该反应需在酸性介质中进行?” |
试剂选择 | “能否用盐酸酸化?为什么?” |
离子共存 | “下列离子在某 pH 下能否大量共存?” |
实验解释 | “pH 过高/过低对反应有何影响?” |
方程式书写 | “写出酸性/碱性条件下的离子方程式” |
定量分析 | “计算某 pH 下的电极电势或反应方向” |
教学与备考建议
1. 强化“条件意识”:
凡涉及 MnO₄⁻、Cr₂O₇²⁻、ClO⁻、H₂O₂ 等,必问“在什么条件下?”
2. 熟记典型物质的 pH 依赖性(见下表):
氧化剂/还原剂 | 酸性条件 | 碱性条件 |
|---|---|---|
KMnO₄ | → Mn²⁺(强氧化) | → MnO₂ 或 MnO₄²⁻(弱氧化) |
K₂Cr₂O₇ | → Cr³⁺(有效) | → CrO₄²⁻(无氧化性) |
Cl₂ | 与还原剂反应 | 歧化为 Cl⁻ + ClO⁻/ClO₃⁻ |
H₂O₂ | 稳定,可作氧化剂/还原剂 | 易歧化分解 |
Fe²⁺ | 较稳定 | 易被 O₂ 氧化为 Fe(OH)₃ |
3. 训练“解释类”答题模板:
“在______条件下,(物质)会(变化),导致______(结果),因此需控制 pH 在______范围。”
掌握这些命题规律,学生不仅能应对高考,更能理解化学反应背后的条件控制智慧——这正是科学素养的核心所在。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
在金属催化偶联反应中中,钯催化剂最为常用,但钯有各种价态...
...
在氧化还原反应中,氧化剂得电子被还原生成还原产物,还原剂...
溶液的酸碱性对氧化还原反应具有显著且多方面的影响,主要体...
在氧化还原反应中,“档次” 本质是氧化性 / 还原性的强弱等级...
一、氧化剂标准电极电势从强到弱排序表 二、还原剂标准电极电...