
|
学习小专题 |

|
学习小专题 |
 [注解与辨疑y] 钯催化剂的价态,是怎么计算的? 作者:化学自习室 来源:未知 日期:2026-01-13 10:56:41 点击:827 所属专题:化合价
[注解与辨疑y] 钯催化剂的价态,是怎么计算的? 作者:化学自习室 来源:未知 日期:2026-01-13 10:56:41 点击:827 所属专题:化合价
在金属催化偶联反应中中,钯催化剂最为常用,但钯有各种价态,零价,二价,四价,钯这些价态是如何得到的? 先看看各种价态的钯催化剂 常见零价钯有 三苯基膦钯PdPPh, 四三苯基膦钯 Pd(PPh), 双二亚苄基丙酮钯 Pd(dba),以及钯炭Pd/C 常见二价钯有 二氯化钯 PdCl, 醋...
 [注解与辨疑y] 氧化还原反应及相关化学概念的常见“未必”辨析 作者:化学自习室 来源:未知 日期:2025-11-18 16:02:43 点击:543 所属专题:氧化还原反应概念
[注解与辨疑y] 氧化还原反应及相关化学概念的常见“未必”辨析 作者:化学自习室 来源:未知 日期:2025-11-18 16:02:43 点击:543 所属专题:氧化还原反应概念
...
 [注解与辨疑y] 氧化剂与还原剂对应产物的判断方法 作者:化学自习室 来源:未知 日期:2025-11-14 17:45:26 点击:810 所属专题:氧化还原反应方程式
[注解与辨疑y] 氧化剂与还原剂对应产物的判断方法 作者:化学自习室 来源:未知 日期:2025-11-14 17:45:26 点击:810 所属专题:氧化还原反应方程式
在氧化还原反应中,氧化剂得电子被还原生成还原产物,还原剂失电子被氧化生成氧化产物,产物的判断并非随机,而是遵循 “元素化合价变化规律”“反应条件影响” 及 “物质特性约束” 三大核心原则。掌握这一判断方法,是理解氧化还原反应本质、书写反应方程式的关键,以...
 [注解与辨疑y] 溶液酸碱性对氧化还原反应有哪些影响? 作者:化学自习室 来源:未知 日期:2025-10-27 18:14:36 点击:1032 所属专题:氧化性 还原性
[注解与辨疑y] 溶液酸碱性对氧化还原反应有哪些影响? 作者:化学自习室 来源:未知 日期:2025-10-27 18:14:36 点击:1032 所属专题:氧化性 还原性
溶液的酸碱性对氧化还原反应具有显著且多方面的影响,主要体现在以下几个方面: 一、影响氧化剂或还原剂的氧化/还原能力 许多氧化还原物质的电极电势(即氧化还原能力)依赖于 H 或 OH 浓度,这可通过能斯特方程(Nernst Equation)定量描述: 当反应中涉及 H 或 OH 时...
 [注解与辨疑y] 氧化剂与还原剂的“档次”分级(按强弱程度) 作者:化学自习室 来源:未知 日期:2025-10-09 19:15:37 点击:1023 所属专题:氧化性 还原性
[注解与辨疑y] 氧化剂与还原剂的“档次”分级(按强弱程度) 作者:化学自习室 来源:未知 日期:2025-10-09 19:15:37 点击:1023 所属专题:氧化性 还原性
在氧化还原反应中,“档次” 本质是氧化性 / 还原性的强弱等级,直接决定物质能否与特定对象反应、反应剧烈程度及产物类型。以下结合常见物质,按 “强 - 中 - 弱” 三级分类,同时标注关键特性和应用差异: 一、氧化剂的 “档次” 分级(按氧化性强弱) 1.强氧化剂(“高档...
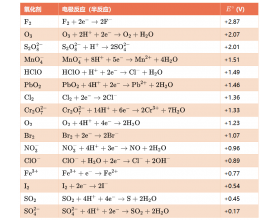 [注解与辨疑y] 氧化剂还原剂相对强弱 作者:化学自习室 来源:未知 日期:2025-09-29 08:23:29 点击:1081 所属专题:氧化性 还原性
[注解与辨疑y] 氧化剂还原剂相对强弱 作者:化学自习室 来源:未知 日期:2025-09-29 08:23:29 点击:1081 所属专题:氧化性 还原性
一、氧化剂标准电极电势从强到弱排序表 二、还原剂标准电极电势从强到弱排序表 三、关键说明 1.电极电势与氧化性或还原性: E Θ 值越大,氧化剂夺取电子的能力越强(如 F 2 >O 3 >Mn O 4 - ),E Θ 越小,还原剂失去电子的能力越强(如LiNaK) 正值的还原剂(如 Fe 2+ 、H...
 [注解与辨疑y] 一些违背常识的化合价 作者:化学自习室 来源:未知 日期:2025-09-05 08:25:35 点击:739 所属专题:化合价
[注解与辨疑y] 一些违背常识的化合价 作者:化学自习室 来源:未知 日期:2025-09-05 08:25:35 点击:739 所属专题:化合价
化学课上,老师总会念叨几句常识:金属元素都显正价,氧元素是-2价,稀有气体最外层电子满了,不跟别人反应……这些约定俗成的规则是我们判断化合价的常识。 但化学的特殊之处就在于:它总是有例外。有一些化合物打破了这些规则,表现出了违背常识的化合价。 一、金属也能...
 [注解与辨疑y] 抗氧化剂就是还原剂吗? 作者:化学自习室 来源:未知 日期:2025-08-17 16:45:23 点击:646 所属专题:抗氧化剂
[注解与辨疑y] 抗氧化剂就是还原剂吗? 作者:化学自习室 来源:未知 日期:2025-08-17 16:45:23 点击:646 所属专题:抗氧化剂
很多人在选购保健品时,都会特别关注抗氧化这个功能。商家也常常宣传我们的产品富含抗氧化成分。但你知道吗?抗氧化剂和还原剂之间,并不是简单的等号关系。 确实,我们生活中常见的很多抗氧化剂都是还原剂。比如维生素C,它能直接给自由基提供电子,自己则被氧化。再比如维...
 [注解与辨疑y] 酸度对重铬酸根及高锰酸根的氧化性有什么影响? 作者:化学自习室 来源:未知 日期:2025-08-12 09:47:52 点击:729 所属专题:重铬酸钾 高锰酸钾
[注解与辨疑y] 酸度对重铬酸根及高锰酸根的氧化性有什么影响? 作者:化学自习室 来源:未知 日期:2025-08-12 09:47:52 点击:729 所属专题:重铬酸钾 高锰酸钾
酸度对重铬酸根Cr2O72-氧化性的影响 酸度对重铬酸根Cr2O72-氧化性有什么影响?酸度对MnO4- 还原产物有什么影响? 1 小结: 由上述数据可见,Cr2O72-的氧化能力(E由1.50V→1.36V→0.95V)随酸度的降低而明显减弱。 凡有H+参加的电极反应,酸度对电极电势的影响都是很大的...
 [注解与辨疑y] 强弱氧化剂的分水岭 作者:王笃年 来源:未知 日期:2024-11-21 15:07:33 点击:654 所属专题:氧化剂 氧化性
[注解与辨疑y] 强弱氧化剂的分水岭 作者:王笃年 来源:未知 日期:2024-11-21 15:07:33 点击:654 所属专题:氧化剂 氧化性
Fe 3+ /Fe 2+ 的标准电极电势为0.77V,高于I 2 /I - 的0.54V,低于N O 3 - ,H + /NO的0.96V。Fe 3+ 是一种中等强度的氧化剂,它可氧化S 2- 、SO 2 、I - 和Fe、Cu等金属单质。 高温条件下Fe(III)也可被Al、C、CO、H 2 还原为单质铁。 可将Fe 3+ 视为强弱氧化剂的...
 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
在金属催化偶联反应中中,钯催化剂最为常用,但钯有各种价态...
...
在氧化还原反应中,氧化剂得电子被还原生成还原产物,还原剂...
溶液的酸碱性对氧化还原反应具有显著且多方面的影响,主要体...
在氧化还原反应中,“档次” 本质是氧化性 / 还原性的强弱等级...
一、氧化剂标准电极电势从强到弱排序表 二、还原剂标准电极电...
化学课上,老师总会念叨几句常识:金属元素都显正价,氧元素...
酸度对重铬酸根Cr2O72-氧化性的影响 酸度对重铬酸根Cr2O72-氧化性...