
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
π键一定比σ键能量小吗?这一问题是由下面两个教学场景引出的:
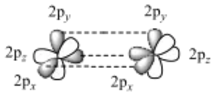
场景一,选修2物质结构与性质:两个C原子在成键时,两个C原子的2px轨道先头碰头形成σ键,两个C原子的2py轨道再头碰头形成π键。
场景二,选修3有机化合物基础:CH2=CH2与Br2加成时,断裂碳碳 π键,保留碳碳 σ键。
上述两个场景中,教师都会向学生传达一个信息——碳碳 π键的键能低于碳碳 σ键。很多教师会将两个场景的内容进行整合,基于场景一的理论解释场景二的反应。这是一种非常有逻辑的教学方式,可以打破知识模块间的壁垒,培养学生结构决定性质的化学观点。
有的教师会对上述内容进行迁移和拓展——任意两个原子成键时,都是σ键的键能大于π键。需要格外注意的是,这是一种错误的迁移和拓展。先来看下面的数据:
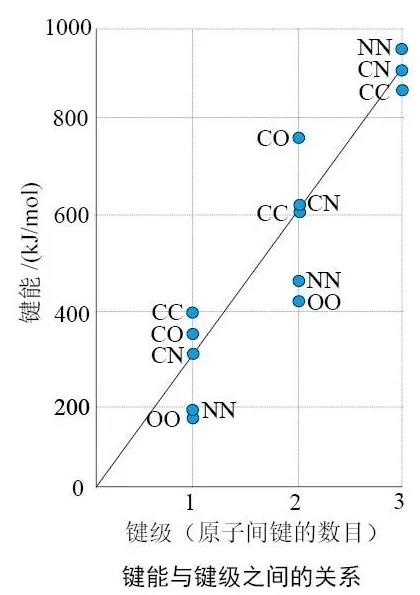
上面的数据显示,C=C双键的强度小于C—C单键的2倍,说明碳碳 π键的键能低于碳碳 σ键,这体现在发生加成反应时断裂碳碳 π键而保留碳碳 σ键。然而,绝不能将我们熟悉的碳的这种性质轻率地外推至其他元素的化学键。上图显示,N=N双键(键能409 kJ·mol-1)的强度高于N—N单键(键能163 kJ·mol-1)的2倍,而N≡N三键(键能946 kJ·mol-1)比5倍N—N单键的强度还要强。也就是说,氮氮之间π键比σ键更稳定。读者可能会提出质疑:既然氮氮之间π键比σ键更稳定,那么两个N原子在成键的过程中,为什么还是先形成σ键后形成π键呢?为什么不能只形成π键而不形成σ键?回答这个问题其实很简单。让我们想象一下N的3个相互垂直的2p轨道,两个N原子的2px和2py轨道如果要肩并肩重叠,从空间几何关系来看,其2pz轨道必然要头碰头。
基于这种趋势,具有氮氮多重键的化合物比仅具有NN单键的聚合物或三维的多原子分子更稳定,所以N元素的单质是具有N≡N三键的双原子分子(N2),而不是像白磷那种具有P—P单键的四面体结构,或红磷那种只含有单键的聚合物结构。P—P、P=P和P≡P键的键能分别为200 kJ·mol-1、310 kJ·mol-1和490 kJ·mol-1,对P元素而言,π键不如σ键稳定(这与C元素相似)。因此,P元素以P—P单键形式存在于各种固体中,包括白磷的正四面体P4分子和红磷那种只含有单键的聚合物结构。这也能够说明为什么P元素的单质不像同主族的N元素那样形成含有P≡P键的P2分子(P2分子是只在高温低压下存在的瞬态物种)。
可见,π键比σ键能量小,这一结论在高中教学中只源自C元素,不可随意迁移或拓展到其他元素,还是要看数据。
参考文献:
Weller Overton.Routke Armstrong.Inorganic Chemistry(6th edition)[M].高等教育出版社,53-54

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
冠醚是一类大环多醚化合物,其分子结构呈环状,环上均匀分布...
在高考备考化学试卷里,经常会遇到含钯的催化剂。本文将就钯...
在离子晶体中存在离子极化现象,使得离子键带有一定共价键的...
【情境】:你注意到我们每天都离不开的水有什么反常之处吗?...
氢键的大小(强度)可以通过多种因素来比较,这些因素包括氢键...
...