
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
本文来自微信公众号:一个芦老师,作者:芦峰
我们先来看电离能与电子亲合能的概念,然后再分析,化学家为什么要提出电负性的概念。
1、电离能
使原子失去电子变成正离子,要消耗一定的能量以克服核对电子的吸引。使某元素1 mol 基态气态原子失去一个电子形成正一价的气态离子时所需要的能量,叫做这种元素的第一电离能,常用符号I1表示。
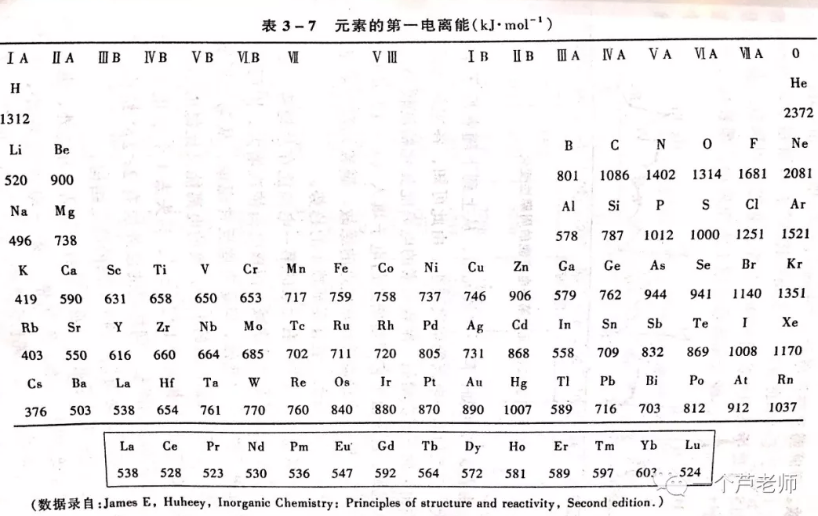
I1越小的元素的原子越容易失去电子,金属性越强。因此,I1是衡量元素金属性的一种尺度。下表列出了周期表中元素的I1数据:
请与下面的原子半径对比:

可见,整体上说,原子半径越小,I1越大,这是由于原子半径越小,原子核对外层的引力就越大。同周期过渡元素的原子半径相差不大,所以I1也很接近。
个别元素如N、P,其半径分别大于O、S,I1却更大,,是因为N和P最外层满足半满结构,难失去电子;0族元素的原子由于满足8电子稳定结构,I1也很大。
2、电子亲合能
使某元素1 mol 基态气态原子得到一个电子形成负一价的气态离子时所释放的能量,叫做这种元素的第一电子亲合能,常用符号E1表示。个别元素的基态气态原子在结合电子时会吸收能量,这时E1取负值(这一点是历史原因,与我们一般表示能量的正负号相反)。
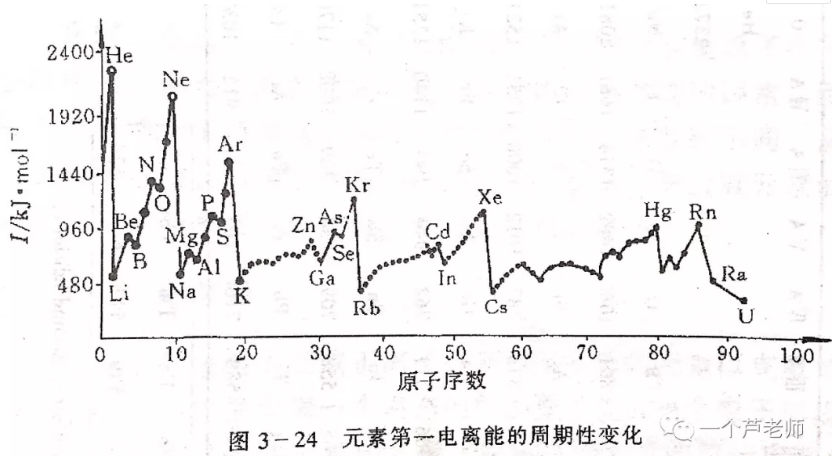
E1越大的元素越容易得到电子,非金属性越强。因此,E1是衡量元素非金属性的一种尺度。下表列出了周期表中元素的E1数据:

再与原子半径对比:

可见,整体上说,原子半径越小,E1越大,这是由于原子半径越小,原子核对外层的引力就越大。
个别元素如O、F,由于其半径过小,电子云密度过高,以致当原子结合一个电子形成负离子时,电子间的排斥力过大,放出的能量反而分别比S、Cl略小。N元素的E1目前没有被实验测得,但经理论计算,N原子在结合一个电子时会吸收能量,所以其E1为负值。
通过对元素电离能和电子亲合能概念的梳理,我们可以得到如下结论:
1.电离能是衡量元素金属性的一种尺度
2.电子亲合能是衡量元素非金属性的一种尺度
3.整体上来说,半径影响着元素的电离能和电子亲合能
科学家测量出电离能和电子亲合能的数据就满足了吗?不,科学家还要用一个概念把元素的电离能和电子亲合能统合起来,这个概念就是元素的电负性!
3、电负性
元素的电离能和电子亲合能分别从失电子能力和得电子能力两个侧面反映了元素的金属性和非金属性。但在形成化合物时,元素的原子经常既不失去也不得到电子,如CH4,电子只是在两种元素间发生偏移,这就不能用电离能和电子亲合能的数据进行解释了。所以,只从电离能或电子亲合能的大小来判断元素的金属性或非金属性是有局限性的。为了较好地说明在化合物中原子“拉”电子的能力(不一定完全得到,也许只是偏移过来),历史上有三位科学家,试图将电离能和电子亲合能统合为一个概念。这三个人分别是密立根、鲍林和阿莱—罗周。
密立根非常简单粗暴,直接把I1和E1加到一起,再取个平均值,就算是把两个概念统合为一个概念了,他把这个新的概念叫做元素的电负性,可见,密立根电负性的单位是kJ/mol。
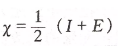
鲍林的方法更简单,直接把F元素的得电子能力规定为4.0(另有资料说鲍林把H元素的得电子能力规定为2.1),连个单位都没有,其他元素的得电子能力与F对比,就可以求出各自的得电子能力。鲍林也把这个概念称为元素的电负性。可见,电负性越大,元素的原子得电子能力越强,反之,失电子能力越强。
阿莱—罗州在鲍林和密立根各自提出电负性的20多年后,也提出了电负性的概念。他把核对外层电子的静电引力规定为元素的电负性。核对外层电子的静电引力的计算公式为
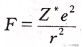
式中z为核电荷数(实际是有效电荷,高中生自行忽略),r为原子半径。阿莱—罗州本想用这个引力来表示元素的电负性,但是经过与鲍林的电负性数据对比,他发现自己计算出的这个引力数据与鲍林的电负性数据有线性关系!这让他更加确认了自己统合电离能和电子亲合能的方法是符合科学界主流认知的。为了让自己的电负性数据与鲍林的吻合,阿莱—罗州在引力公式里加入了两个参数,进行了修正:
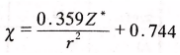
鲍林和阿莱—罗州的电负性数据一并列入下表:
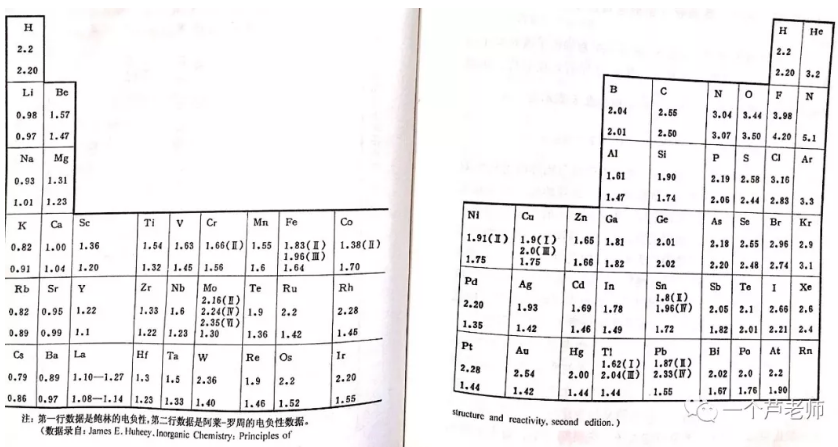
由于电子亲合能的实验数据很不好测得,所以密立根的电负性概念很少被用到,高中教材采用的是鲍林的电负性概念。
经过对元素的电离能、电子亲合能和电负性概念的学习,我们发现:
电负性的提出是为了统合电离能和电子亲合能的,以更全面地度量一种元素的金属性或非金属性。所以能够用I1和E1解释的化学现象,一般都能用电负性来解释。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
...
原子核外电子的真实运动状态是我们肉眼看不到的,但是可以通...
铜原子(Cu)的基态电子排布为[Ar] 3d4s,失去一个电子形成亚铜...
先让大家看看高中和大学电负性的数值图:下面的人教版高中化...
在元素周期表中,除了同周期从左到右、同主族从上到下的性质...
电负性是描述原子在化合物中吸引成键电子能力的核心物理量,...