
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
硼,元素符号B,价电子构型2s22p1,第二周期第ⅢA族。
作为非金属,最高氧化数对应的水合物肯定显酸性,硼酸分子式写为B(OH)3或者H3BO3。
一般来说,非金属含氧酸的酸性是由与中心原子相连的羟基-OH解离出氢离子H+表现的,因此有几个羟基H,就可以解离出几个氢离子,称为几元酸,例如高氯酸HClO4是一元酸,H2SO4是二元酸,H3PO4是三元酸。照此说来,硼酸H3BO3应该是三元酸,但是它却是一元酸,而且是很弱的一元酸。
试推一下,如果H3BO3是三元酸,与b相连的-OH解离H+,解离得越容易酸性越强,←解离容易必须要求B原子对羟基O的结合非常牢固,←进而要求B应该是电荷高半径小;同时也要求溶剂H2O分子对H+的结合非常牢固。看起来以上这两个条件在H3BO3水溶液中确实是都存在的。
但是,与其他无机含氧酸不同的是,H3BO3作为酸如果断开O-H键给出H+的同时,它还存在有一个不需要断键就可以直接利用的空轨道(缺电子是硼化合物最大的特点),而H2O分子也有时刻准备着给出的O原子上的孤对电子,当然普通情况下这个孤对电子是以氢键形式被利用起来了的,但是断开氢键可比断开共价键要容易多了。
所以,H3BO3表现的酸性,其实不是自己表现的质子酸的酸性,而是自己做了Lewis酸,溶剂H2O做了它的Lewis碱的同时又表现出的质子酸的性质。
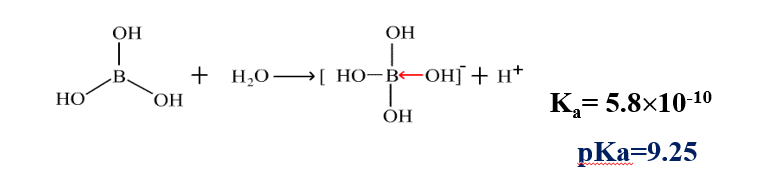
所以硼酸H3BO3是一元酸。
酸性太弱了,弱到没有达到定量分析的要求,想办法让它的酸性增强一点,也就是想办法让H2O分子与它形成的酸碱加合物更稳定一点,H2O解离的H+就会更多一点。
所以硼酸水溶液中的B-OH和多元醇的-OH脱水缩合生成了具有稳定环状结构的硼酸酯,促进H2O分子的解离,溶液酸性增强。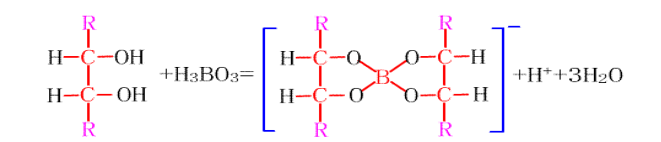
这个与多元醇形成的硼酸酯的结构很稳定,以至于硼酸在做缓冲溶液时,可以增强多羟基化合物的荧光。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。在元素周期表中,除了同周期从左到右、同主族从上到下的性质递变规律外,还存在一种特...
电负性是描述原子在化合物中吸引成键电子能力的核心物理量,是连接原子结构与化学键性...
【导读】第一电离能(I)和第一电子亲和能(E)从能量变化的角度描述了同一个过程的正反两...
电离能和电子亲和能都是研究元素游离态的原子的性质。电离能是衡量元素金属性大小的物...
硼,元素符号B,价电子构型2s 2 2p 1 ,第二周期第ⅢA族。 作为非金属,最高氧化数对...
多电子原子中,在考虑某个电子时,可以把其他电子对其排斥作用看作削弱了原子核对它的...