
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、基本概念和意义
电子亲和能(Electronic Affinity)又称电子亲和势,是化学中描述原子结合电子能力的关键参数,定义为基态气态原子获得一个电子形成-1价气态阴离子时释放的能量。单位为kJ/mol(SI单位为J/mol)。
第一电子亲和能(E₁)通常放出能量,一般记为负值,而第二电子亲和能(E₂)因需克服阴离子间的排斥力需吸收能量,一般记为正值。
例:Cl(g) + e- = Cl⁻(g) E1=-348.6kJ/mol
F(g) + e- = F⁻(g) E1=-327.9kJ/mol
说明:符号争议与教材差异,部分权威教材(如清华大学)遵循热力学惯例,放热记为负值;而早期教材可能相反。当前主流倾向于放热为负值以与焓变符号统一,但实际很多文献中非金属的电子亲和能常以正值列出。所用符号也是多种多样如EA1、A1、Y1等。本文分享选择从众。
当前教材仍采用相反表示的,如下图中鲁科版教材《物质结构与性质》。

电子亲和能的物理意义
元素的电子亲和能反映了元素的原子得到电子的难易程度。元素原子的第一电子亲和能为负值时,绝对值值愈大,表明该元素的一个基态的气态原子得到一个电子形成-1价气态阴离子时所放出的能量越多,元素原子得到电子的倾向愈大,元素的非金属性也愈强。
二、电子亲和能的影响因素
电子亲和能的大小主要取决于以下因素:
原子半径、有效核电荷、电子构型和电子间排斥。
1.原子半径:原子半径越小,核对外层电子吸引力越强,电子亲和能数值越大(如F > Cl)。
2.有效核电荷:有效核电荷数越大,对电子束缚力越强,电子亲和能数值通常越大(如O < F)。
3.电子构型:
电子构型接近稀有气体的稳定构型的元素(如卤素的7电子价层)易得电子,放热多,电子亲和能数值大。
例如:氟的电子亲合能为327.9kJ /mol ,表示氟原子加合一个电子时,要放出327.9kJ/mol的能量, 即它得电子的能力很强,是典型的非金属性元素。
半充满(如N的2p³)或全充满轨道因结构稳定,加合一个电子时反而要吸热,结构越稳定,吸收能量越多。
4.电子间排斥:外层电子密度高时(如O⁻),新增电子受排斥,当负一价离子再获得电子时要克服负电荷之间的排斥力,因此要吸收能量,以此类推可知E2、E3等为正值(注:表示吸热)。
三、电子亲和能的周期性规律
在元素周期表中,电子亲和能呈现以下变化趋势:
同周期:从左到右,电子亲和能数值递增趋势
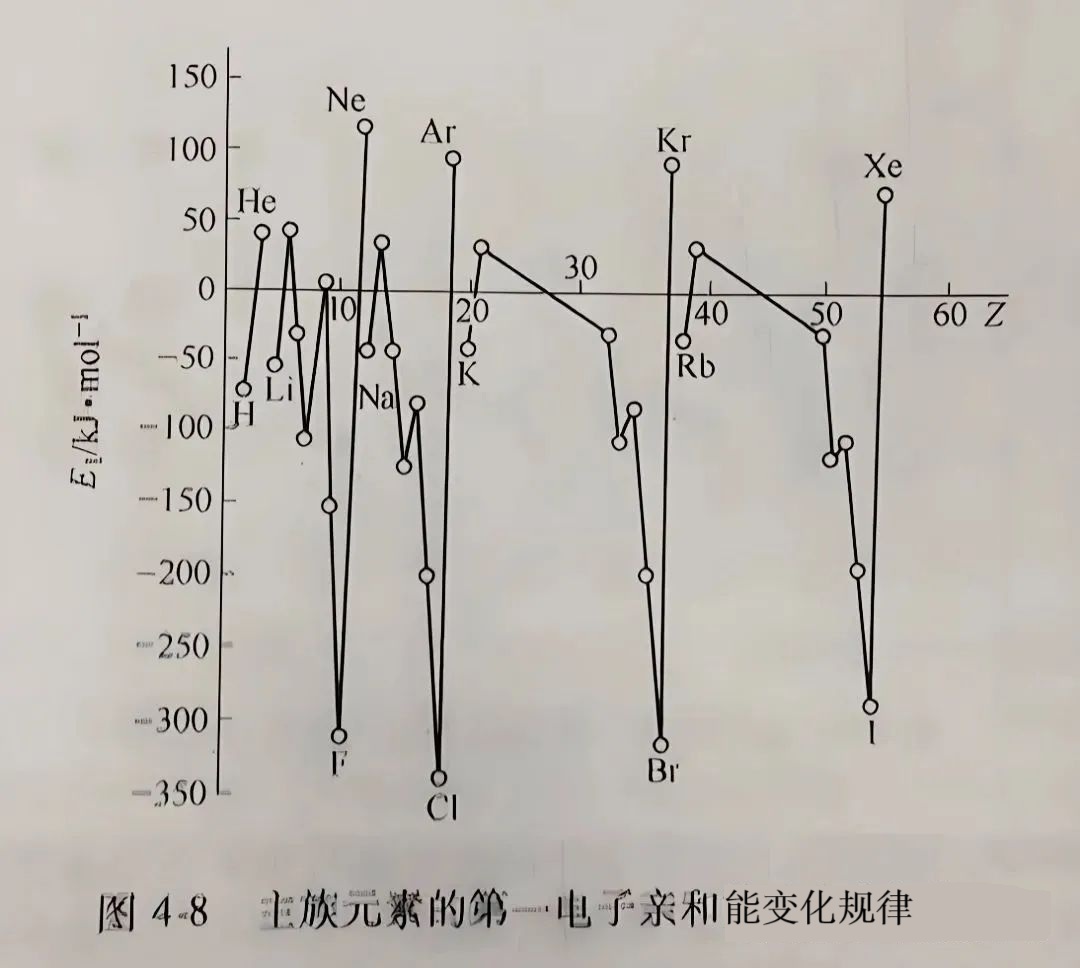
例外:ⅤA族,如N因p³半充满,第一电子亲和能为正值(需吸能)。
稀有气体和ⅡA族元素(如He、Be)因电子层全满,第一电子亲和能为正值(需吸能)。
同主族:自上而下,电子亲和能数值递减趋势。
例外:VIA和VIIA电子亲和能绝对值最大的并不是每族的第一种元素O和F,而是第二种元素S和Cl。
这一反常现象可以解释为:第二周期的氧和氟的原子半径较小,电子密度大,电子间的排斥力强,以致当原子结合1个电子形成负离子时,放出的能量较少,而第二种元素硫和氯的半径较大,且同一层中有空的d轨道可容纳电子,电子的排斥力小,因此形成一价负离子时放出的能量最多。
主族元素的第一电子亲和能规律图

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。电负性是描述原子在化合物中吸引成键电子能力的核心物理量,是连接原子结构与化学键性...
【导读】第一电离能(I)和第一电子亲和能(E)从能量变化的角度描述了同一个过程的正反两...
电离能和电子亲和能都是研究元素游离态的原子的性质。电离能是衡量元素金属性大小的物...
硼,元素符号B,价电子构型2s 2 2p 1 ,第二周期第ⅢA族。 作为非金属,最高氧化数对...
多电子原子中,在考虑某个电子时,可以把其他电子对其排斥作用看作削弱了原子核对它的...
1.核外电子共有几个能层? 能层电子层,根据离原子核远近的不同,由里向外可分为第一、二...