
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、 什么是活化能?
活化能,通常用符号Ea表示,其标准单位为kJ/mol,定义为化学反应中,反应物分子转化为产物分子所必须克服的最低能量。它不是反应的总能量变化,而是反应过程中必须跨越的一个能量障碍,这个障碍通常被称为能垒(Energy Barrier)。
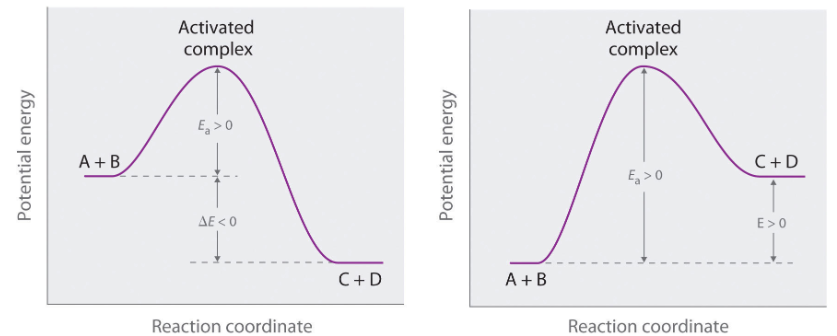
在一个反应的能量坐标图中,反应物和产物分别处于两个能量山谷。要从反应物山谷到达产物山谷,反应体系的能量必须沿着反应路径攀升,达到一个能量最高点,这个最高点就是所谓的过渡态。活化能,在物理图像上,就是反应物的平均能量与这个过渡态能量之间的差值。
1、活化能有什么作用?
活化能的大小直接决定了过程进行的难易程度和速率,其重要性体现在多个核心科学与技术领域。
(1)反应速率的总开关:活化能是调控化学反应速率最根本的参数。
高活化能意味着需要克服一个巨大的能垒,在特定温度下,只有极少数分子拥有足够的能量跨越这个门槛,因此反应速率非常慢。
低活化能意味着能垒较低,大量分子都能轻易跨越,反应速率因此很快。许多酸碱中和反应的活化能就很低,几乎是瞬间完成。

温度对反应速率的巨大影响,正是通过活化能这一媒介实现的。温度升高,分子的平均动能增加,拥有超过活化能的分子比例呈指数级增长,从而导致反应速率急剧加快。
(2)催化的核心原理:催化剂之所以能够神奇地加速反应,其核心机理就是降低反应的活化能。
催化剂通过与反应物相互作用,改变了原有的反应路径,提供了一条全新的、能垒更低的路径。它就像是在原有的高山旁边开凿了一条隧道,使得巨石(反应物)可以轻易地穿过,而无需翻越高耸的山峰。
重要的是,催化剂只改变了路径和山峰的高度(活化能),但没有改变起点和终点的海拔差(反应焓变ΔH),即不影响反应的整体热力学平衡。

2、如何量化活化能?
(1)阿伦尼乌斯方程
阿伦尼乌斯方程是描述化学反应速率常数(k)随温度(T)变化的经验公式,也是计算活化能的基础。其经典形式为:

其中,k:速率常数,直接反映反应的快慢;A:指前因子或频率因子,代表在最佳方向上碰撞的总频率,与分子的碰撞频率和空间位阻有关。Ea:活化能(J/mol或kJ/mol)。R:理想气体常数(8.314J/(mol·K));K:绝对温度(K)。
该方程清晰地揭示了:速率常数k与温度T呈指数关系。温度越高,指数项越大,反应速率越快。活化能Ea越高,指数项越小,反应速率越慢。
(2)艾林方程(Eyring Equation)
过渡态理论为阿伦尼乌斯方程提供了坚实的理论基础,并推导出了更为精密的艾林方程。它将宏观的速率常数与微观的分子热力学参数直接关联起来:

其中,κ透射系数,通常假定为1,表示所有越过能垒的活化络合物都能成功转化为产物;kB:玻尔兹曼常数;h:普朗克常数;ΔG‡:活化吉布斯自由能,即反应物到过渡态的吉布斯自由能变化。

<
艾林方程的深刻之处在于:
(1)它为阿伦尼乌斯方程中的指前因子A提供了明确的物理意义,它不仅与温度有关,还与活化熵ΔS‡密切相关。
(2)它将能垒分解为焓(ΔH‡)和熵(ΔS‡)的贡献。ΔH‡大致对应于阿伦尼乌斯活化能,反映了键的断裂和形成所需的能量变化。ΔS‡则反映了从反应物到过渡态时体系混乱度的变化,例如分子构象的束缚或自由度的改变。

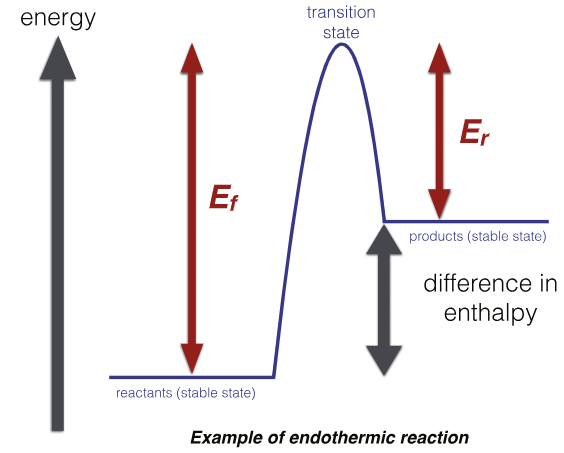
二、 什么是能垒?
能垒是描述系统从一种稳定状态转变为另一种稳定状态所需克服的能量障碍的核心概念。在化学动力学中,能垒被明确定义为化学反应必须克服的能量障碍,以使反应物成功转化为产物。
在物理学中,它表示系统从一个势能阱向另一个势能阱过渡时必须超越的能量阈值。

1、能垒有什么作用?
(1)热力学与动力学的桥梁作用
能垒在化学热力学与动力学之间起到关键的衔接作用。热力学仅决定反应的平衡位置,而动力学则通过能垒决定反应路径的可行性。即使热力学上高度有利,若能垒过高,反应在常规条件下也可能难以观测。
在复杂反应中,能垒的相对高度决定了反应路径的选择性。例如,在有机合成中,多种可能的产物往往对应不同的能垒路径,最优合成路线通常是能垒最低的路径。这种能垒控制的选择性是理性设计催化剂和反应条件的理论基础。
(2)材料性能的决定性因素
在材料科学中,能垒主导着多种关键物理过程:
扩散行为:原子或离子在晶格中的迁移需要克服迁移能垒,直接决定材料的离子导电性和自扩散系数。
相变动力学:马氏体相变、铁电相变等结构转变需克服相变能垒,影响相变温度和动力学路径。
电化学反应:电极反应的动力学由电化学能垒控制,该能垒与静电特性、共价键合和离子特性密切相关。

三、活化能与能垒有什么区别?
1、基础定义的重叠与混淆
在化学动力学领域,活化能与能垒的术语混用现象极为普遍。活化能被定义为反应物分子达到过渡态所需的最小能量,即克服能量障碍的阈值;而能垒则被直接描述为活化能的物理表现形式—势能面上的势垒高度。
关键矛盾点在于:实验测得的Arrhenius活化能是宏观统计量,具有温度依赖性;而理论计算的势能垒是微观量子化学量,通常指0K下过渡态与反应物的电子能差,二者并非严格等价。这种差异在复杂反应体系中会被显著放大。

2、根本差异
从统计力学视角,活化能的本质是活化分子与一般分子的平均能量之差,是一个统计平均量。它与阈能(分子发生反应所需的最小平动能)和能垒(势能面鞍点能量)在数值上接近,但理论定义截然不同。具体而言:
活化能:宏观动力学参数,通过速率常数温度依赖性定义,具有实验可操作性。
能垒:微观势能面特征,由过渡态几何结构决定,具有计算确定性。


 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
活化分子百分数和活化分子数,理解它对掌握化学反应速率至关...
化学反应的焓变越大,代表这个反应受温度变化的影响越大吗?...
在化学热力学和分析化学中,我们常常听到这样的说法:“如果...
...
一、 什么是活化能? 活化能,通常用符号Ea表示,其标准单位为...
一、基本定义 (一)中间体 1、根据国际纯粹与应用化学联合会...