
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、酰胺的命名
酰胺(amides)可以看作是氨或胺分子中氮原子上的氢原子被酰基取代以后得到的化合物,也可以看作是羧酸分子中羧基上的羟基被氨基或烃氨基取代后的化合物,它属于羧酸衍生物。

1、简单酰胺
可根据氨基所连的酰基命名,称为“某酰胺”
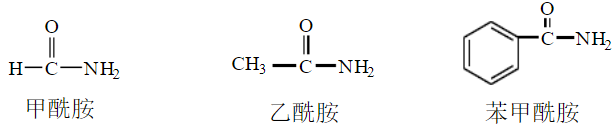
2、取代酰胺的命名
为了区别氮上的烃基和酰基上的烃基,将氮原子上的取代基放在“某酰胺”的前面,用N表示该烃基连在氮原子上;亦可称为“某酰某胺”,例如:

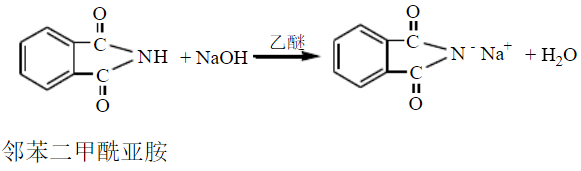
两个酰基同时连在1个氮原子上的化合物称为酰亚胺,例如:

二、酰胺的性质
(一)酸碱性
先胺是近中性的化合物。其水溶液不显碱性,不能使石蕊试纸变色。
自于p- π共轭体系的形成,酰胺分子中氮原子电子云密度降低,氮氢键极性增强,因此氨基上的氢能表现出极弱的酸性,如果酰胺分子中的氮原子同时与两个酰基相连形成酰亚胺化合物,氮原子上的氢有明显的酸性,能与强碱生成盐。例如:
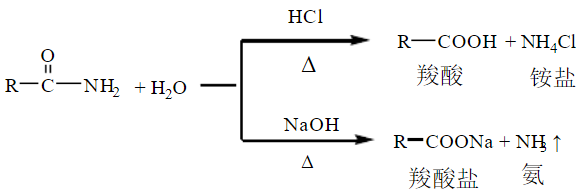
(二)水解反应
酰胺和酰氯等羧酸衍生物一样,也能够发生水解反应,但水解反应非常缓慢,必须在酸或碱的催化下加热进行。
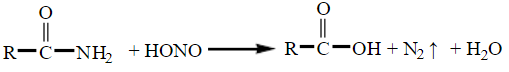
(三)与亚硝酸反应
酰胺与亚硝酸反应,氨基被羟基取代,生成相应的羧酸,同时放出氮气。
(四)霍夫曼降解反应
在氢氧化钠的碱性溶液中,酰胺与卤素(即次卤酸钠的碱性溶液)反应,酰胺可失去羰基,生成比原酰胺少一个碳原子的伯胺,此反应称为为霍夫曼(Hofman)降解反应。

三、 尿素
尿素是碳酸的二元酰胺,它可以看作是碳酸分子中2个羟基被胺基取代后的化合物,称碳酰二胺,简称为脲。

尿素的化学性质与酰胺相似,在酸或碱或酶催化下可水解,强热时分解成氨和二氧化碳。
尿素的主要化学性质有:
1、弱碱性
尿素具有弱碱性,但碱性很弱,它的水溶液不能使石蕊试液变色,只能与强酸作用生成盐。如与硝酸、草酸作用形成不溶于水的白色不溶性盐沉淀,常利用这一性质从尿液中分离尿素。

2、水解反应
与酰胺一样,尿素在酸或碱或酶催化下加热或在酶的作用下发生水解反应

3、尿素与亚硝酸反应:
尿素能与亚硝酸反应放出氮气,同时生成碳酸,后者立即分解为二氧化碳与水。
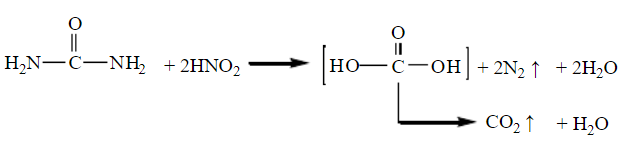
可通过氮气的体积计算尿素的含量。
4、缩二脲反应
将尿素加热并超过其熔点时,两分子尿素间脱去一分子氨,生成缩二脲。
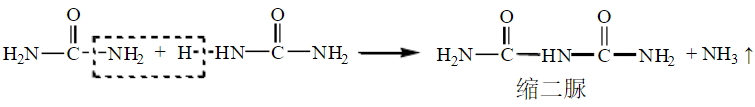
在缩二脲碱性溶液中加入稀硫酸铜溶液,呈现紫红色,此颜色反应称为缩二脲反应。
凡分子中含有2个或2个以上的![]() 结构的化合物,都可以发生缩二脲反应,如多肽、蛋白质等。
结构的化合物,都可以发生缩二脲反应,如多肽、蛋白质等。
小结:
1.酰胺(amides)可以看作是氨或胺分子中氮原子上的氢原子被酰基取代后的化合物,也可以看作是羧酸分子中羧基上的羟基被氨基或烃氨基取代后的化合物,它属于羧酸衍生物。
2. 简单酰胺可根据氨基所连的酰基命名,称为“某酰胺” 。取代酰胺的命名,为了区别 氮上的烃基和酰基上的烃基,将氮原子上的取代基放在“某酰胺” 前面,用N表示该烃基连 在氮原子上;亦可称为“某酰某胺”。
3. 酰胺的性质
(1) 酸碱性:
酰胺是近中性的化合物。其水溶液不显碱性,不能使石蕊试纸变色。酰 亚胺化合物有明显的酸性,能与强碱生成盐。
(2) 水解反应:
在酸或碱的催化下加热,酰胺能够发生水解反应。
(3) 与亚硝酸反应:
酰胺与亚硝酸反应,氨基被羟基取代,生成相应的羧酸,同时放 出氮气。
(4) 霍夫曼降解反应:
在氢氧化钠的碱性溶液中, 酰胺与卤素反应,酰胺可失去羰基, 生成比原酰胺少一个碳原子的伯胺,此反应称为霍夫曼( Hofmann)降解反应。
4. 尿素是碳酸的二元酰胺,它可以看作是碳酸分子中 2个羟基分别被氨基取代后的化 合物,称碳酰二胺,简称为脲。
5. 尿素主要化学性质
(1) 弱碱性:
尿素具有弱碱性,但碱性很弱,它的水溶液不能使石蕊变色,只能与强 酸作用生成盐。
(2) 水解反应:
尿素在酸、碱催化下加热或在酶的作用下发生水解反应。
(3) 尿素与亚硝酸反应:
尿素能与亚硝酸反应放出氮气,同时生成碳酸,后者立即分 解为二氧化碳和水。
(4) 缩二脲反应:
将尿素加热并超过其熔点时,两分子尿素间脱去一分子氨,生成缩二脲。在缩二脲的碱 性溶液中加入稀硫酸铜溶液,呈现紫红色,此颜色反应称为缩二脲反应。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
要理解溴的四氯化碳溶液不能与饱和醛发生反应,核心在于反应...
酸酐(Acid Anhydride)是一类在无机化学与有机化学中均具有重要...
一、电子效应:官能团的“性格”密码 在比较酸性前,必须先理...
有机氰化物是指分子中含有氰基(-CN,氰基中 C 与 N 以三键连接...
有机化学中的还原反应是高考核心考点之一,其本质是有机分子...
【导读】环氧乙烷与HO的反应是亲核加成反应,其本质是环氧乙...