
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求。
【2025河南等级考】1. 活字印刷术极大地促进了世界文化的交流,推动了人类文明的进步。下列“活字”字坯的主要成分为硅酸盐的是
|
|
|
|
A.泥活字 | B.木活字 | C.铜活字 | D.铅活字 |
A. A B. B C. C D. D
【答案】A
【解析】
【详解】A.泥活字的主要材料是粘土,粘土的主要成分是硅酸盐,A正确;
B.木活字主要成分是纤维素,B错误;
C.铜活字是铜合金,主要成分是铜,C错误;
D.铅活字主要成分是铅,D错误;
故选A。
【2025河南等级考】2. 下列化学用语或图示正确的是
A. 反-1,2-二氟乙烯的结构式: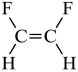
B. 二氯甲烷分子的球棍模型: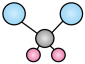
D. 用电子式表示CsCl的形成过程: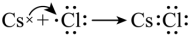
【答案】B
【解析】
【详解】A.顺式结构中,两个相同的原子或基团位于双键的同一侧;而反式结构中,两个相同的原子或基团分别位于双键的两侧,所以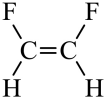 为顺-1,2-二氟乙烯,A错误;
为顺-1,2-二氟乙烯,A错误;
B.二氯甲烷中含有两根碳氢键和两根碳氯键,键长不一样,球棍模型为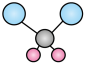 ,B正确;
,B正确;
C.基态S原子的价电子排布式为3s23p4,轨道表示式: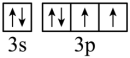 ,C错误;
,C错误;
D.氯化铯为离子化合物,用电子式表示CsCl的形成过程: ,D错误;
,D错误;
故选B。
【2025河南等级考】3. 下列图示中,实验操作或方法符合规范的是
|
|
|
|
A.溶解氯化钠固体 | B.量取20.00mL草酸溶液 | C.收集二氧化碳气体 | D.观察钠与水的反应 |
A. A B. B C. C D. D
【答案】B
【解析】
【详解】A.溶解氯化钠固体应该在烧杯中进行,为了加快溶解,可用玻璃棒搅拌,不能在试管中溶解,A错误;
B.滴定管能精确到两位小数,量取20.00mL草酸溶液,要选择酸式滴定管,实验操作符合规范,B正确;
C.收集二氧化碳可用向上排空气法,但不能用瓶塞塞紧集气瓶,这样空气排不出去,而且易发生爆炸,C错误;
D.钠与水的反应比较剧烈,而且产生的氢氧化钠有腐蚀性,不能把眼睛凑上去观察,D错误;
故选B
【2025河南等级考】4. X是自然界中一种常见矿物的主要成分,可以通过如图所示的四步反应转化为Q(略去部分参与反应的物质和反应条件)。已知X和Q的组成元素相同。

下列说法错误的是
A. Y常用作油漆、涂料等的红色颜料 B. 溶液Z加热煮沸后颜色会发生变化
C.R→Q 反应需要在强酸性条件下进行 D. Q可以通过单质间化合反应制备
【答案】C
【解析】
【分析】X是自然界中一种常见矿物的主要成分,根据溶液Z、R、Q的颜色可知X中含有铁元素,根据固体颜色可知X是FeS2,Y是Fe2O3,溶液中Z含有Fe3+、溶液R中含有Fe2+,Q是FeS。
【详解】A.Fe2O3可用作油漆、涂料等的红色颜料,A正确;
B.含有Fe3+的溶液加热转化为Fe(OH)3胶体,溶液颜色发生变化,B正确;
C.FeS可溶于酸,所以R→Q反应不能在酸性溶液中进行,C错误;
D.在加热条件下Fe和S化合生成FeS,D正确;
答案选C。
【2025河南等级考】5. 对于下列过程中发生的化学反应。相应离子方程式正确的是
A. 磷酸二氢钠水解:H2PO4-+H2O H3PO4+OH-
H3PO4+OH-
B. 用稀盐酸浸泡氧化银:Ag2O+2H+=2Ag++2H2O
C. 向次氯酸钠溶液中加入碘化氢溶液:ClO-+H+=HClO
D. 向硫酸氢钠溶液中滴加少量碳酸氢钡溶液:H++SO42-+Ba2++HCO3-=BaSO4↓+CO2↑+H2O
【答案】A
【解析】
【详解】A.磷酸二氢钠水解产生OH-,离子方程式为H2PO4-+H2O H3PO4+OH-,A正确;
H3PO4+OH-,A正确;
B.用稀盐酸浸泡氧化银生成AgCl沉淀,离子方程式为Ag2O+2H++2Cl-=2AgCl+H2O,B错误;
C.向次氯酸钠溶液中加入碘化氢溶液发生氧化还原反应,离子方程式为ClO-+2I-+2H+=I2+Cl-+H2O,C错误;
D.向硫酸氢钠溶液中滴加少量碳酸氢钡溶液,反应的离子方程式为2H++SO42-+Ba2++2HCO3-=BaSO4↓+2CO2↑+2H2O,D错误;
答案选A。
【2025河南等级考】6. 我国科研人员合成了一种深紫外双折射晶体材料,其由原子序数依次增大的五种短周期元素Q、W、X、Y和Z组成。基态X原子的s轨道中电子总数比p轨道中电子数多1,X所在族的族序数等于Q的质子数,基态Y和Z原子的原子核外均只有1个未成对电子,且二者核电荷数之和为Q的4倍。下列说法正确的是
A. QY3为极性分子 B. ZY为共价晶体
C. 原子半径:W>Z D. 1个X2分子中有2个π键
【答案】D
【解析】
【分析】Q、W、X、Y和Z为原子序最依次增大的短周期元素,基态X原子的s轨道中电子总数比P轨道中电子数多1,X是N;X所在族的族序数等于Q的质子数,Q是B,所以W是C;基态Y和Z原子的原子核外均只有1个未成对电子,且二者核电荷数之和为Q的4倍,即质子数之和为20,所以Y是F,Z是Na。
【详解】A.BF3为平面正三角形结构,结构对称,属于非极性分子,A错误;
B.NaF是离子晶体,B错误;
C.同周期自左向右原子半径逐渐减小,同主族从上到下原子半径逐渐增大,则原子半径C<Li<Na,C错误;
D.N2分子中含有三键,所以含有2个π键,D正确;
答案选D。
【2025河南等级考】7. 化合物M是从红树林真菌代谢物中分离得到的一种天然产物,其结构如图所示。下列有关M的说法正确的是
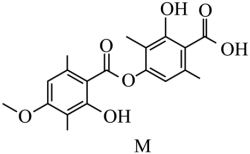
A. 分子中所有的原子可能共平面
B. 1mol M最多能消耗4mol NaOH
C. 既能发生取代反应,又能发生加成反应
D. 能形成分子间氢键,但不能形成分子内氢键
【答案】C
【解析】
【详解】A.该分子中存在-CH3,因此不可能所有原子共面,故A项错误;
B.该分子中能与NaOH反应的官能团为2个酚羟基、酯基(1个普通酯基、1个酚酯基)、1个羧基,除酚羟基形成的酯基外,其余官能团消耗NaOH的比例均为1:1,因此1mol M最多能消耗5mol NaOH,故B项错误;
C.M中存在羟基、羧基等,能够发生取代反应,存在苯环结构,因此能发生加成反应,故C项正确;
D.M中存在羟基、羧基,能形成分子间氢键,由于存在羟基与羧基相邻的结构,因此也能形成分子内氢键,故D项错误;
综上所述,说法正确的是C项。
【2025河南等级考】8. 某同学设计以下实验,探究简单配合物的形成和转化。
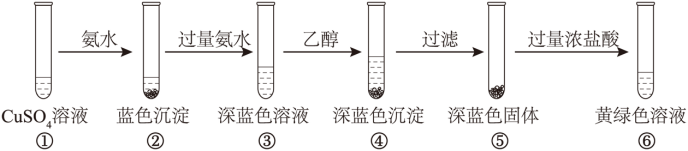
下列说法错误的是
A. ②中沉淀与④中沉淀不是同一种物质
B. ③中现象说明配体与Cu2+的结合能力:NH3>H2O
C. ④中深蓝色物质在乙醇中的溶解度比在水中小
D. 若向⑤中加入稀硫酸,同样可以得到黄绿色溶液
【答案】D
【解析】
【分析】该实验过程中,相关物质转化如下: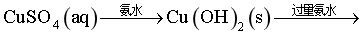
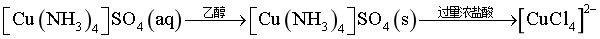 。
。
【详解】A.②中沉淀为Cu(OH)2(s),④中沉淀为[Cu(NH3)4]SO4(s),二者不是同一物质,故A项说法正确;
B.③中含有的溶质为[Cu(NH3)4]SO4(s),Cu2+与NH3中N原子形成配位键,而未与H2O中O形成配位键,说明配体结合能力:NH3>H2O,故B项说法正确;
C.[Cu(NH3)4]SO4(s)为离子化合物,属于强极性物质,乙醇属于极性相对低的有机物,向[Cu(NH3)4]SO4(s)的水溶液中加入乙醇,扩大了溶质与溶剂的极性差,使得[Cu(NH3)4]SO4(s)在水溶液中析出,即[Cu(NH3)4]SO4(s)在乙醇中的溶解度小于在水中,故C项说法正确;
D.由于⑥中溶液呈黄绿色是由于含有[CuCl4]2-,因此向⑤中加入稀硫酸无法得到黄绿色溶液,故D项说法错误;
综上所述,说法错误的是D项。
【2025河南等级考】9. 自旋交叉化合物在分子开关、信息存储等方面具有潜在的应用价值。某自旋交叉化合物的结构及在氯气气氛下的热重曲线分别如图1和图2所示。该化合物的相对分子质量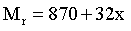 (x为整数)。
(x为整数)。
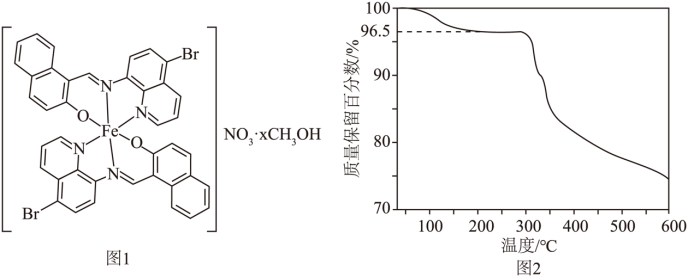
下列说法正确的是
A. x=1 B. 第一电离能:C<N<O
C. 该化合物中不存在离子键 D. 该化合物中配位数与配体个数相等
【答案】A
【解析】
【详解】A.该化合物在氦气的气氛中加热,先失去CH3OH,若x=1,CH3OH的质量分数为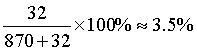 ,结合图像可知,该化合物中x=1,故A项说法正确;
,结合图像可知,该化合物中x=1,故A项说法正确;
B.同周期元素从左到右,第一电离能呈增大趋势,但N原子2p轨道为半充满稳定结构,第一电离能:N>O>C,故B项说法错误;
C.该化合物中,配离子与NO3-之间为离子键,故C项说法错误;
D.该化合物中,根据O、N原子成键数可知,O-Fe为共价键,N-Fe为配位键,配位数为与中心原子或离子键合的原子总数,因此配位数为6,配体为与中心原子或离子形成配位键的分子或离子个数,因此配体个数为2,故D项说法错误;
综上所述,说法正确的为A项。
【2025河南等级考】10. 在催化剂a或催化剂b作用下,丙烷发生脱氢反应制备丙烯,总反应的化学方程式为CH3CH2CH3(g) CH3CH=CH2(g)+H2(g),反应进程中的相对能量变化如图所示(*表示吸附态,*CH3CHCH2+2*H→CH3CH=CH2(g)+H2(g)中部分进程已省略)。
CH3CH=CH2(g)+H2(g),反应进程中的相对能量变化如图所示(*表示吸附态,*CH3CHCH2+2*H→CH3CH=CH2(g)+H2(g)中部分进程已省略)。
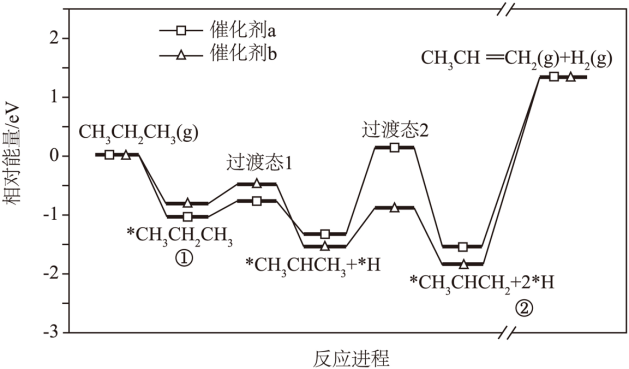
下列说法正确的是
A. 总反应是放热反应
B. 两种不同催化剂作用下总反应的化学平衡常数不同
C. 和催化剂b相比,丙烷被催化剂a吸附得到的吸附态更稳定
D. ①转化为②的进程中,决速步骤为*CH3CH2CH3→*CH3CHCH3+*H
【答案】C
【解析】
【详解】A.由图可知,生成物能量高,总反应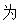 吸热反应,A错误;
吸热反应,A错误;
B.平衡常数只和温度有关,与催化剂无关,B错误;
C.由图可知,丙烷被催化剂a吸附后能量更低,则被催化剂a吸附后得到的吸附态更稳定, C正确;
D.活化能高的反应速率慢,是反应的决速步骤,故决速步骤为*CH3CHCH3→*CH3CHCH2+*H或*CH3CHCH3+*H→*CH3CHCH2+2*H,D错误;
故选C。
【2025河南等级考】11. 可持续高分子材料在纺织、生物医用等领域具有广阔的应用前景。一种在温和条件下制备高性能可持续聚酯P的路线如图所示。
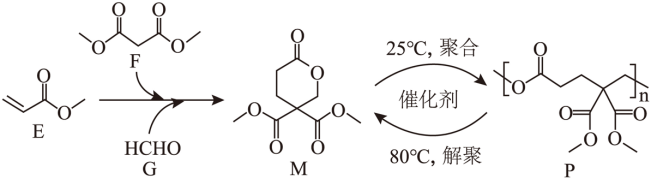
下列说法错误的是
A. E能使溴的四氯化碳溶液褪色
B. 由E、F和G合成M时,有HCOOH生成
C. P在碱性条件下能够发生水解反应而降解
D. P解聚生成M的过程中,存在C-O键的断裂与形成
【答案】B
【解析】
【详解】A.E含有碳碳双键,能使溴的四氯化碳溶液褪色,A正确;
B.由氧原子守恒推断,产物不是甲酸,由反应原理推断,E与F发生碳碳双键的加成反应生成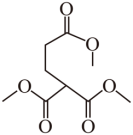 ,再与甲醛发生加成反应,再脱去1分子CH3OH可生成M,B错误;
,再与甲醛发生加成反应,再脱去1分子CH3OH可生成M,B错误;
C.P中含有酯基,在碱性条件下,酯基会水解,导致高分子化合物降解, C正确;
D.P解聚生成M的过程中,存在酯基中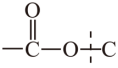 碳氧键的断裂,形成M过程中存在C-O键的生成,D正确;
碳氧键的断裂,形成M过程中存在C-O键的生成,D正确;
故选B。
【2025河南等级考】12. 一种液流电解池在工作时可以实现海水淡化,并以LiCl形式回收含锂废弃物中的锂元素,其工作原理如图所示。
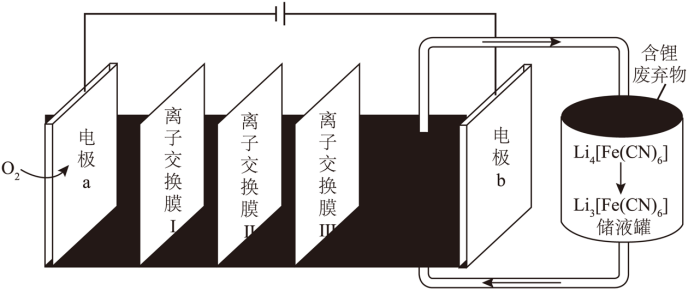
下列说法正确的是
A. Ⅱ为阳离子交换膜
B. 电极a附近溶液的pH减小
C. 电极b上发生的电极反应式为[Fe(CN)6]4-+e-= [Fe(CN)6]3-
D. 若海水用NaCl溶液模拟,则每脱除58.5g NaCl,理论上可回收1molLiCl
【答案】D
【解析】
【分析】由图可知,左侧为阴极,电极反应为O2+4e-+2H2O=4OH-,右侧为阳极,电极反应为[Fe(CN)6]4--e-= [Fe(CN)6]3,在膜Ⅰ和膜Ⅱ间加入海水,钠离子透过膜Ⅰ进入阴极区得到氢氧化钠,氯离子透过膜Ⅱ进入膜Ⅱ与膜Ⅲ之间,锂离子透过膜Ⅲ进入膜Ⅱ与膜Ⅲ之间,在此处得到LiCl,则膜Ⅰ为阳膜,膜Ⅱ为阴膜,膜Ⅲ为阳膜,据此解答。
【详解】A.由分析可知,膜Ⅱ为阴膜, A错误
B.a电极的反应为O2+4e-+2H2O=4OH-,pH变大,B错误;
C.由分析可知,电极b的反应为[Fe(CN)6]4--e-= [Fe(CN)6]3,C错误;
D.每脱除58.5gNaCl,转移电子数为1mol,有1molLi+和1molCl-分别透离子交换膜Ⅲ、膜Ⅱ,可得到1molLiCl,D正确;
故选D
【2025河南等级考】13. 在MoS2负载的Rh-Fe催化剂作用下,CH4可在室温下高效转化为CH3COOH,其可能的反应机理如图所示。
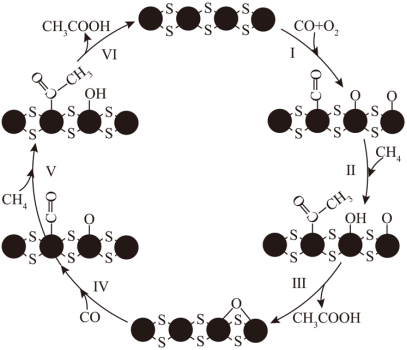
下列说法错误的是
A. 该反应的原子利用率为100%
B. 每消耗1molO2可生成1molCH3COOH
C. 反应过程中,Rh和Fe的化合价均发生变化
D. 若以CD4为原料,用H2O吸收产物可得到CD3COOH
【答案】B
【解析】
【分析】由反应历程可知,总反应为2CO+2CH4+O2=2CH3COOH,据此解答。
【详解】A.该反应为化合反应,原子利用率为100%,A正确;
B.由分析可知,每消耗1molO2可生成2molCH3COOH,B错误;
C.由反应历程可知,催化剂Rh-Fe有连接4个S原子和2个S原子的,这两种类型的原子成键数目均会发生改变,所以Rh和Fe的化合价均发生变化,C正确;
D.若以CD4为原料,有反应历程可知,会生成CD3COOD,用H2O吸收产物时,其存在电离平衡:CD3COOD CD3COO-+D+,CD3COO-结合水电离出
CD3COO-+D+,CD3COO-结合水电离出 H+可得到CD3COOH,D正确;
H+可得到CD3COOH,D正确;
故选B。
【2025河南等级考】14. 乙二胺(H2NCH2CH2NH2,简写为Y)可结合H+转化为[H2NCH2CH2NH3]+(简写为HY+)[H3NCH2CH2NH3]2+(简写为H2Y2+)。Ag+与Y可形成[AgY]+和[AgY2]+两种配离子。室温下向AgNO3溶液中加入Y,通过调节混合溶液的pH改变Y的浓度,从而调控不同配离子的浓度(忽略体积变化)。混合溶液中Ag+和Y的初始浓度分别为1.00×10-3mol/L和1.15×10-2mol/L。 与
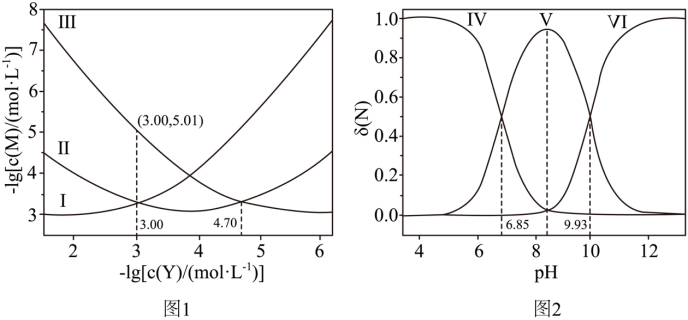
与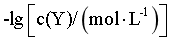 的变化关系如图1所示(其中M代表Ag+、[AgY]+或[AgY2]+),分布系数δ(N)与pH的变化关系如图2所示(其中N代表Y、HY+或H2Y2+)。比如
的变化关系如图1所示(其中M代表Ag+、[AgY]+或[AgY2]+),分布系数δ(N)与pH的变化关系如图2所示(其中N代表Y、HY+或H2Y2+)。比如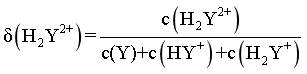 。
。
下列说法错误的是
A. 曲线I对应的离子是[AgY2]+
B.δ(HY+) 最大时对应的pH=8.39
C. 反应Ag++Y [AgY]+的平衡常数K1=104.70
[AgY]+的平衡常数K1=104.70
D. 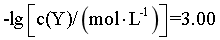 时,
时,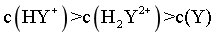
【答案】D
【解析】
【分析】Ag+与Y可形成[AgY]+和[AgY2]+两种配离子,发生的反应为Ag++Y [AgY]+、[AgY]++Y
[AgY]+、[AgY]++Y [AgY2]+,故随着Y浓度的变大,Ag+浓度变小,[AgY]+先增大后减小,[AgY2]+增大,则从图像上(从右向左表示Y浓度的变大)可以看出,曲线Ⅰ表示[AgY2]+浓度,Ⅱ表示浓度[AgY]+浓度,Ⅲ表示Ag+浓度;同理,调节溶液pH,当酸性较强时,H2Y2+浓度大,当碱性较强时,Y的浓度大,故曲线Ⅳ表示H2Y2+浓度,曲线Ⅴ表示HY+浓度,曲线Ⅵ表示Y 浓度,据此解题。
[AgY2]+,故随着Y浓度的变大,Ag+浓度变小,[AgY]+先增大后减小,[AgY2]+增大,则从图像上(从右向左表示Y浓度的变大)可以看出,曲线Ⅰ表示[AgY2]+浓度,Ⅱ表示浓度[AgY]+浓度,Ⅲ表示Ag+浓度;同理,调节溶液pH,当酸性较强时,H2Y2+浓度大,当碱性较强时,Y的浓度大,故曲线Ⅳ表示H2Y2+浓度,曲线Ⅴ表示HY+浓度,曲线Ⅵ表示Y 浓度,据此解题。
【详解】A.由分析可知,曲线Ⅰ表示[AgY2]+,A正确;
B.由题意可知,Y可以视为二元弱碱,第一次电离方程式为:Y+H2O HY++OH-,
HY++OH-,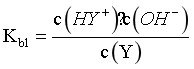 ,当
,当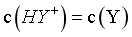 时,
时,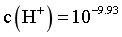 ,
,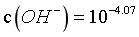 ,则
,则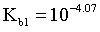 ,同理
,同理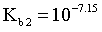 ,
,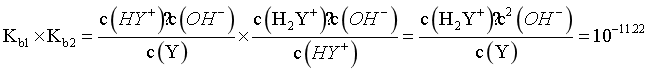 ,由图像可知,当
,由图像可知,当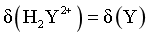 时,
时,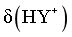 最大,则
最大,则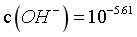 ,pOH=5.61,pH=8.39,B正确;
,pOH=5.61,pH=8.39,B正确;
C.反应Ag++Y [AgY]+的平衡常数
[AgY]+的平衡常数 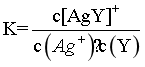 ,由图可知,当
,由图可知,当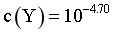 时,
时,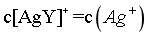 ,则
,则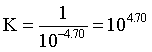 ,C正确;
,C正确;
D.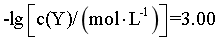 时,
时,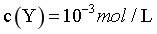 ,
,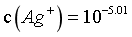 ,
,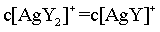 ,由物料守恒可知,
,由物料守恒可知,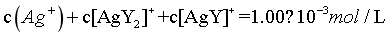 ,则
,则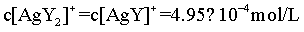 ,Y的初始浓度为
,Y的初始浓度为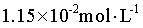 ,由物料守恒得
,由物料守恒得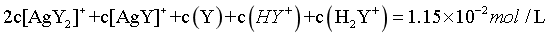 ,代入数据,
,代入数据,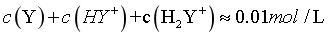 ,则
,则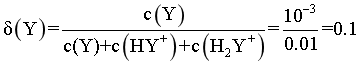 ,由图像可知,pH在8.39-9.93之间,此时
,由图像可知,pH在8.39-9.93之间,此时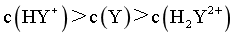 ,D错误;
,D错误;
故选D。
二、非选择题:本题共4小题,共58分。
【2025河南等级考】15. 一种从预处理得到的贵金属合金粉[主要成分为Fe、Rh(铑)、Pt,含有少量SiO2]中尽可能回收铑的工艺流程如下:
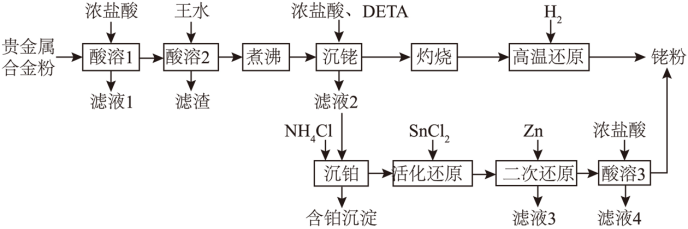
回答下列问题:
(1)“酸溶1”的目的是_______。
(2)已知“酸溶2”中Rh转化为H3[RhCl6],则生成该物质的化学方程式为_______;“滤渣”的主要成分是_______(填化学式)。
(3)“沉铑”中得到的沉淀经“灼烧”后分解成铑单质,但夹杂少量Rh2O3和RhCl3,则“高温还原”中发生反应的化学方程式为_______。
(4)若“活化还原”在室温下进行,SnCl2初始浓度为1.0×10-4mol/L,为避免生成Sn(OH)2沉淀,溶液适宜的pH为_______(填标号)[已知Sn(OH)2的Ksp=5.5×10-28]。
A.2.0 B.4.0 C.6.0
(5)“活化还原”中,SnCl2必须过量,其与Rh(III)反应可生成[Rh(SnCl3)5]4-,提升了Rh的还原速率,该配离子中Rh的化合价为_______;反应中同时生成[RhCl6]2-,Rh(III)以[RhCl6]3-计,则理论上SnCl2和Rh(III)反应的物质的量之比为_______。
(6)“酸溶3”的目的是_______。
【答案】(1)溶解Fe,使其进入溶液,从而通过过滤实现分离
(2) ①.Rh+6HCl+3HNO3=H3[RhCl6]+3NO2↑+3H2O ②. SiO2
(3)Rh2O3+3H2 2Rh+3H2O、2RhCl3+3H2
2Rh+3H2O、2RhCl3+3H2 2Rh+6HCl
2Rh+6HCl
(4)A (5) ①. +1 ②. 6:1
(6)除去滤渣中未反应的Zn
【解析】
【分析】贵金属合金粉[主要成分为Fe、Rh(铑)、Pt,含有少量SiO2]中尽可能回收铑的工艺流程中,加入浓盐酸溶解其中Fe,过滤后实现分离,再向滤渣中加入王水(浓盐酸与浓硝酸混合酸)氧化溶解Rh,Rh转化为H3[RhCl6],Pt转化为相关可溶物,SiO2不溶,过滤后进行分离;煮沸滤液除去盐酸、硝酸,再加入浓盐酸、DETA将部分铑元素沉淀,过滤后,滤渣进行灼烧分解为Rh、Rh2O3和RhCl3,再用H2进行高温还原得到铑单质,向滤液中加入NH4Cl将铂元素相关化合物转化为沉淀除去,加入SnCl2将Rh(III)转化为[Rh(SnCl3)5]4-,再加入Zn进行还原,生成Rh,由于Zn过量有剩余,加入浓盐酸溶解过量的Zn,实现Zn与Rh分离,过滤获得铑粉,以此分析解答。
【小问1详解】
原料合金粉主要成分为Fe、Rh、Pt和少量SiO2,Fe易溶于酸(如盐酸或硫酸),而Rh和Pt在常温下不易被非氧化性酸溶解,SiO2不溶于酸,因此“酸溶1”使用非氧化性酸溶解Fe生成可溶性盐,过滤后Fe(II)进入滤液,剩余滤渣主要为Rh、Pt和SiO2,实现初步分离,故答案为:溶解Fe,使其进入溶液,从而通过过滤实现分离。
【小问2详解】
“酸溶2”中Rh转化为H3[RhCl6],Rh元素化合价由0升高至+3,HNO3中N元素化合价由+5降低至+4,结合化合价升降守恒以及原子守恒可知反应化学方程式为Rh+6HCl+3HNO3=H3[RhCl6]+3NO2↑+3H2O;由上述分析可知该过程中滤渣的主要成分为SiO2。
【小问3详解】
“高温还原”过程中,Rh2O3和RhCl3均被H2还原为Rh,Rh元素化合价均由+3降低至0,根据化合价升降守恒以及原子守恒可知反应方程式为Rh2O3+3H2 2Rh+3H2O、2RhCl3+3H2
2Rh+3H2O、2RhCl3+3H2 2Rh+6HCl。
2Rh+6HCl。
【小问4详解】
SnCl2初始浓度为1.0×10-4mol/L,则溶液中c(Sn2+)=1.0×10-4mol/L,当恰好生成Sn(OH)2沉淀时,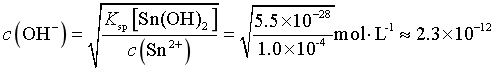 ,
,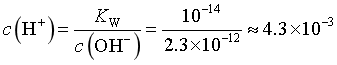 ,
,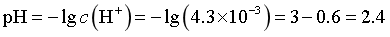 ,因此为避免生成Sn(OH)2沉淀,溶液的pH<2.4,故答案为A。
,因此为避免生成Sn(OH)2沉淀,溶液的pH<2.4,故答案为A。
【小问5详解】
配离子[Rh(SnCl3)5]4-中,配体[RhCl3]-带1个负电荷,设Rh的化合价为x,则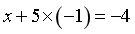 ,则x=+1;Rh(III)以[RhCl6]3-计,反应中Rh(III)还原至Rh(I),每个Rh得到2个电子,SnCl2为还原剂,部分被氧化为[RhCl6]2-,Sn(II)被氧化为Sn(IV),每个Sn失去2个电子,同时反应过程中,部分SnCl2结合一个Cl-形成[RhCl3]-,作为新的配体,每生成1个[Rh(SnCl3)5]4-,需要5个SnCl2,因此理论上SnCl2和Rh(III)反应的物质的量之比为
,则x=+1;Rh(III)以[RhCl6]3-计,反应中Rh(III)还原至Rh(I),每个Rh得到2个电子,SnCl2为还原剂,部分被氧化为[RhCl6]2-,Sn(II)被氧化为Sn(IV),每个Sn失去2个电子,同时反应过程中,部分SnCl2结合一个Cl-形成[RhCl3]-,作为新的配体,每生成1个[Rh(SnCl3)5]4-,需要5个SnCl2,因此理论上SnCl2和Rh(III)反应的物质的量之比为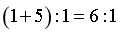 。
。
【小问6详解】
由于“二次还原”过程中,为确保[Rh(SnCl3)5]4-完全反应,加入的Zn需过量,过滤后剩余Zn和生成物Rh存在于滤渣中,因此再向滤渣中加入浓盐酸的目的为:除去滤渣中未反应的Zn。
【2025河南等级考】16. 某研究小组设计了如下实验测定某药用硫黄中硫的含量,其中硫转化的总反应为S+2OH-+3H2O2=SO42-+4H2O。
主要实验步骤如下:
Ⅰ.如图所示,准确称取m g细粉状药用硫黄于①中,并准确加入V1mLKOH乙醇溶液(过量),加入适量蒸馏水,搅拌,加热回流。待样品完全溶解后,蒸馏除去乙醇。
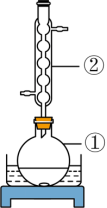
Ⅱ.室温下向①中加入适量蒸馏水,搅拌下缓慢滴加足量30%H2O2溶液,加热至100℃,保持20min,冷却至室温。
Ⅲ.将①中溶液全部转移至锥形瓶中,加入2滴甲基橙指示剂,用c mol/LHCl标准溶液滴定至终点,消耗HCl溶液体积为V2mL。
Ⅳ.不加入硫黄,重复步骤Ⅰ、Ⅱ、Ⅲ做空白实验,消耗HCl标准溶液体积为V3mL。计算样品中硫的质量分数。
Ⅴ.平行测定三次,计算硫含量的平均值。
回答下列问题:
(1)仪器①的名称是:_______;②的名称是_______。
(2)步骤Ⅰ中,乙醇的作用是_______。
(3)步骤Ⅰ中,样品完全溶解后,必须蒸馏除去乙醇的原因是_______。
(4)步骤Ⅱ中不宜采用水浴加热的原因是_______。步骤Ⅱ结束后,若要检验反应后溶液中的SO42-,实验操作是_______。
(5)步Ⅲ中,判断滴定达到终点的现象为_______。
(6)单次样品测定中硫的质量分数可表示为_______(写出计算式)。
【答案】(1) ①. 圆底烧瓶 ②. 球形冷凝管
(2)作溶剂,溶解单质硫
(3)防止双氧水氧化乙醇,影响实验测定结果
(4) ①. 实验需要加热至100 ℃ ②. 取适量混合液先加入盐酸酸化,无明显实验现象,再加入氯化钡溶液产生白色沉淀,说明含有SO42-
(5)滴入最后半滴盐酸,溶液颜色由黄色变为橙色,且半分钟内不褪色
(6)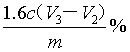
【解析】
【小问1详解】
根据仪器构造可知①是圆底烧瓶,②是球形冷凝管;
【小问2详解】
硫单质难溶于水,微溶于酒精,所以乙醇的作用是作溶剂,溶解单质硫;
【小问3详解】
双氧水具有强氧化性,乙醇具有还原性,二者混合发生氧化还原反应,所以必须蒸馏除去乙醇;
【小问4详解】
由于实验需要加热至100 ℃,而水的沸点就是100 ℃,所以不宜采用水浴加热;要检验溶液中的硫酸根离子,需要排除溶液中其它离子的干扰,所以实验操作是取适量混合液先加入盐酸酸化,无明显实验现象,再加入氯化钡溶液产生白色沉淀,说明含有SO42-。
【小问5详解】
甲基橙作指示剂,盐酸滴定氢氧化钾溶液,则滴定终点的现象为滴入最后半滴盐酸,溶液颜色由黄色变为橙色,且半分钟内不褪色;
【小问6详解】
不加入硫磺,消耗HCl标准溶液体积为V3mL,因此原氢氧化钾的物质的量是0.001cV3mol,反应后剩余氢氧化钾的物质的量是0.001cV2mol,因此与硫磺反应的氢氧化钾的物质的量是0.001c(V3-V2)mol,所以根据方程式S+2OH-+3H2O2=SO42-+4H2O可知硫单质的物质的量0.0005c(V3-V2)mol,所以单次样品测定中硫的质量分数可表示为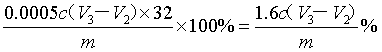 。
。
【2025河南等级考】17. CaCO3的热分解与NixPy催化的CH4重整结合,可生产高纯度合成气(H2+CO),实现碳资源的二次利用。主要反应如下:
反应Ⅰ: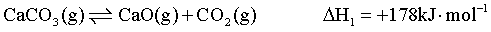
反应Ⅱ: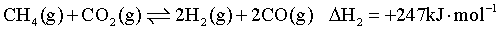
反应Ⅲ: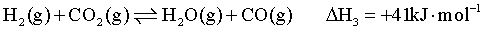
回答下列问题:
(1)Ca位于元素周期表中_______区;基态Ni2+的价电子排布式为_______。
(2)水分子的VSEPR模型与其空间结构模型不同,原因是_______。
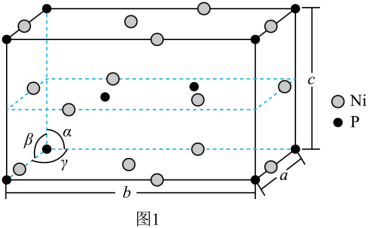
(3)NixP的晶胞如图1所示(晶胞参数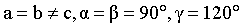 ),该物质的化学式为_______。
),该物质的化学式为_______。
(4)恒压条件下,CH4重整反应可以促进CaCO3分解,原因是_______。
(5)在温度分别为T1、T2和T3下,CH4的平衡转化率与压强的关系如图2所示,反应温度最高的是_______(填“T1”“T2”或“T3”),原因是_______。
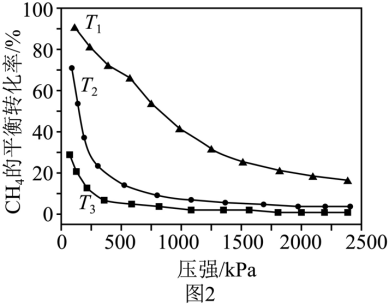
(6)一定温度、100KPa下,向体系中加入1.0molCaCO3和1.omolCH4,假设此条件下其他副反应可忽略,恒压反应至平衡时,体系中CaCO3转化率为80%,CH4转化率为60%,CO物质的量为1.3mol,反应Ⅲ的平衡常数Kp=_______(保留小数点后一位),此时原位CO2利用率为_______。
已知:原位CO2利用率
【答案】(1) ①. s ②. 3d8
(2)O原子上存在2对孤电子对
(3)Ni2P (4)反应Ⅱ消耗反应Ⅰ产生的CO2,降低体系CO2分压,使反应Ⅰ平衡右移
(5) ①. T1 ②. 升高温度,反应Ⅱ正向移动
(6) ①. 1.2 ②. 70%
【解析】
【小问1详解】
Ca原子序数为20,电子排布为[Ar]4s2,价电子位于s轨道,属于周期表s区;Ni原子序数为28,基态电子排布为[Ar] 3d84s2。Ni失去4s能级上2个电子形成Ni2+,价电子排布为3d8,故答案为:s;3d8。
【小问2详解】
中心O原子有2个σ键,孤电子对数为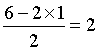 ,共4个价电子对,VSEPR模型为四面体型,空间构型为V型,故答案为:O原子上存在2对孤电子对。
,共4个价电子对,VSEPR模型为四面体型,空间构型为V型,故答案为:O原子上存在2对孤电子对。
【小问3详解】
该晶胞中,P原子8个位于顶点(4个被6个晶胞共用,4个被12个晶胞共用)、2个位于体内,1个晶胞中所含P原子数为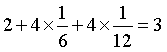 ,Ni原子8个位于棱(均被4个晶胞共用)、6个位于面(均被2个晶胞共用),1个位于体内,Ni原子数为
,Ni原子8个位于棱(均被4个晶胞共用)、6个位于面(均被2个晶胞共用),1个位于体内,Ni原子数为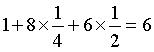 ,因此该物质的化学式为Ni2P。
,因此该物质的化学式为Ni2P。
【小问4详解】
CH4重整反应会消耗CO2,降低体系中CO2分压,使CaCO3分解反应正向移动且反应放热,可以为碳酸钙分解提供能量,故答案为:反应Ⅱ消耗反应Ⅰ产生的CO2,降低体系CO2分压,使反应Ⅰ平衡右移。
【小问5详解】
反应Ⅱ正向为吸热反应,相同压强时,升高温度,反应正向移动,CH4转化率增大,因此温度最高的是T1,故答案为:T1;升高温度,反应Ⅱ正向移动。
【小问6详解】
一定温度、100KPa下,向体系中加入1.0molCaCO3和1.omolCH4,恒压反应至平衡时,体系中CaCO3转化率为80%,反应Ⅰ: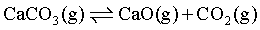 平衡时生成n(CO2)=0.8mol,CH4转化率为60%,CO物质的量为1.3mol,则
平衡时生成n(CO2)=0.8mol,CH4转化率为60%,CO物质的量为1.3mol,则
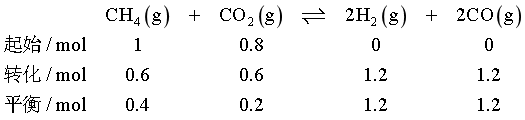
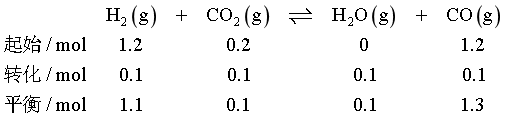
气体总物质的量n总=(1.3+0.1+0.1+1.1+0.4)mol=3mol,
反应Ⅲ的平衡常数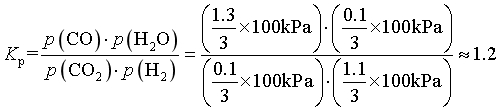 ,CaCO3平衡时
,CaCO3平衡时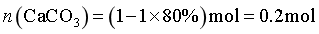 ,原位CO2利用率为
,原位CO2利用率为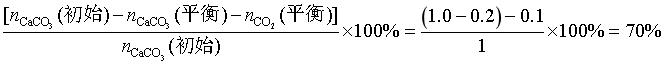 ,故答案为:1.2;70%。
,故答案为:1.2;70%。
【2025河南等级考】18. 化合物I具有杀虫和杀真菌活性,以下为其合成路线之一(部分反应条件已简化)。
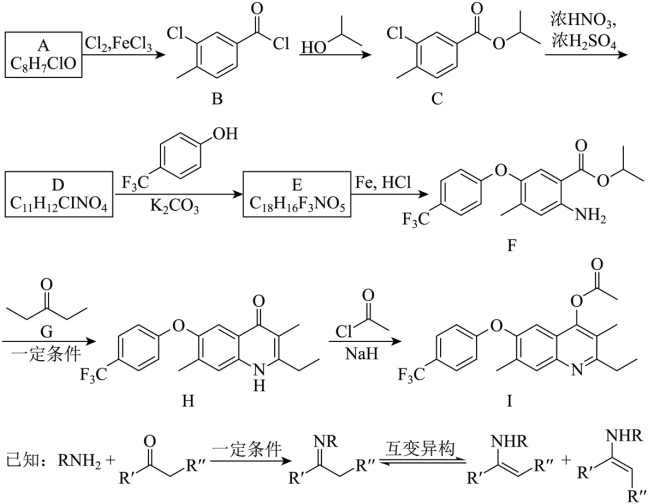
回答下列问题:
(1)I中含氧官能团的名称是_______。
(2)A的结构简式为_______。
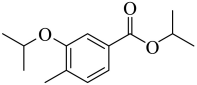
(3)由B生成C的化学方程式为_______。反应时,在加热搅拌下向液体B中滴加异丙醇;若改为向异丙醇中滴加B则会导致更多副产物的生成,副产物可能的结构简式为_______(写出一种即可)。
(4)由D生成E的反应类型为_______。
(5)由F生成H的反应中可能生成中间体J,已知J的分子式为C23H26F3NO3,则J的结构简式为_______(写出一种即可)。
(6)G的同分异构体中,含有碳氧双键的还有_______种(不考虑立体异构);其中,能发生银镜反应,且核磁共振氢谱显示为两组峰的同分异构体的结构简式为_______。
【答案】(1)醚键,酯基
(2) (3) ①.
(3) ①. 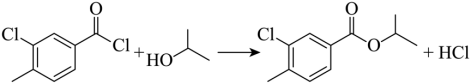 ②.
②. 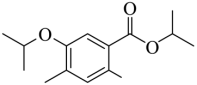
(4)取代反应 (5)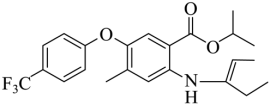
(6) ①. 6 ②. 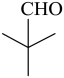
【解析】
【分析】A在氯气和氯化铁催化下生成B,根据B的结构可推出A为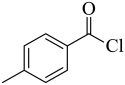 ,B与异丙醇发生取代反应生成C,C与浓硝酸发生取代反应生成D,根据F的结构推出D为
,B与异丙醇发生取代反应生成C,C与浓硝酸发生取代反应生成D,根据F的结构推出D为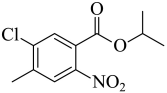 ,D与
,D与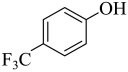 发生取代反应生成E,E为
发生取代反应生成E,E为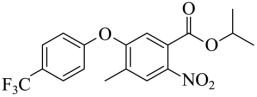 ,E与铁粉,氯化氢发生还原反应生成F,F与3-戊酮在一定条件下生成H,H与乙酰氯发生反应生成I,据此解答。
,E与铁粉,氯化氢发生还原反应生成F,F与3-戊酮在一定条件下生成H,H与乙酰氯发生反应生成I,据此解答。
【小问1详解】
由I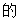 结构式可知,其含氧官能团为醚键,酯基,故答案为:醚键,酯基;
结构式可知,其含氧官能团为醚键,酯基,故答案为:醚键,酯基;
【小问2详解】
由分析可知,A为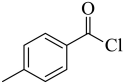 ,故答案为:
,故答案为: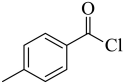 ;
;
【小问3详解】
由分析可知,B与异丙醇发生取代反应生成C和氯化氢,化学方程式为: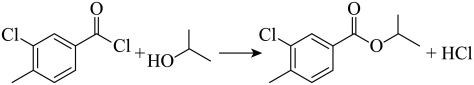 ;反应时,在加热搅拌下向液体B中滴加异丙醇,异丙醇较少,滴加下去优先和活泼的酰氯发生反应,若改为向异丙醇中滴加B,则异丙醇足量,会苯环上的氯原子发生取代,导致更多副产物的生成,副产物的结构简式为
;反应时,在加热搅拌下向液体B中滴加异丙醇,异丙醇较少,滴加下去优先和活泼的酰氯发生反应,若改为向异丙醇中滴加B,则异丙醇足量,会苯环上的氯原子发生取代,导致更多副产物的生成,副产物的结构简式为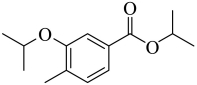 ,故答案为:
,故答案为: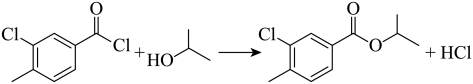 ;
; ;
;
【小问4详解】
根据C的结构推出D为 ,D与
,D与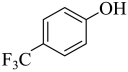 发生取代反应生成E,故答案为:取代反应;
发生取代反应生成E,故答案为:取代反应;
【小问5详解】
由F生成H的反应中可能生成中间体J,已知J的分子式为C23H26F3NO3,说明F生成H发生了已知信息第一步反应,然后第二步反应,第二步两种产物互为顺反异构体,则J的结构简式为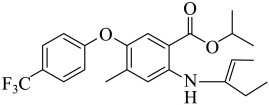 ,故答案为:
,故答案为: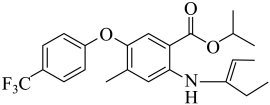 ;
;
【小问6详解】
G为3-戊酮,分子式为C5H10O,它的同分异构体中,含有碳氧双键,说明为醛或酮,若为醛,可以看成将醛基挂在-C4H9上,共有4种同分异构体,分别为: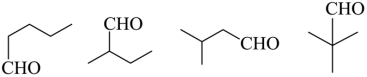 ,若为酮,除了G本身外,共有2种同分异构体,分别为:
,若为酮,除了G本身外,共有2种同分异构体,分别为: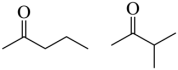 ,共有6种符合要求的同分异构体,其中,能发生银镜反应(含有醛基),且核磁共振氢谱显示为两组峰的同分异构体的结构简式为
,共有6种符合要求的同分异构体,其中,能发生银镜反应(含有醛基),且核磁共振氢谱显示为两组峰的同分异构体的结构简式为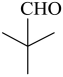 ,故答案为:6;
,故答案为:6;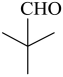 。
。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。一、选择题:本题共 14 小题,每小题 3 分,共 42 分。在每小题给出的四个选项中,只...
一、选择题:本大题共 16 小题,共 44 分。第 1- 题,每小题 2 分;第 11-16 小题,每...
一、选择题:本题共 7 小题,每小题 6 分,共 42 分。在每小题给出的 4 个选项中,只...
一、选择题 ( 本大题共 16 小题,每小题 3 分,共 48 分。每小题列出的四个备选项中只...
1. 定窑是宋代五大名窑之一,其生产的白瓷闻名于世。下列说法正确的是 A. 传统陶瓷是...
可能用到的相对原子质量: H-1 C-12 N-14O-16 Mg-24 S-32 第一部分 本部分共 14 小题...