
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
【2025黑吉辽蒙等级考】11. 某工厂利用生物质(稻草)从高锰钴矿(含MnO2、Co3O4和少量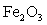 )中提取金属元素,流程如图。已知“沉钴”温度下Ksp(CoS)=10-20.4,下列说法错误的是
)中提取金属元素,流程如图。已知“沉钴”温度下Ksp(CoS)=10-20.4,下列说法错误的是
A. 硫酸用作催化剂和浸取剂
B. 使用生物质的优点是其来源广泛且可再生
C. “浸出”时,3种金属元素均被还原
D. “沉钴”后上层清液中c(Co2+)·c(S2-)=10-20.4
【答案】C
【解析】
【分析】矿石(含MnO2、Co3O4、Fe2O3)经过硫酸和稻草浸出过滤得到滤液,滤液含有Fe3+、Mn2+、Co2+,加入Na2CO3沉铁得到FeOOH,过滤,滤液再加入Na2S沉钴得到CoS,过滤最后得到硫酸锰溶液。
【详解】A.根据分析可知,加入硫酸和稻草浸出,硫酸作催化剂和浸取剂,A正确;
B.生物质(稻草)是可再生的,且来源广泛,B正确;
C.根据图示可知,“浸出”时,Fe的化合价没有变化,Fe元素没有被还原,C错误;
D.“沉钴”后的上层清液存在CoS的沉淀溶解平衡,满足Q=Ksp=c(Co2+)·c(S2-)=10-20.4,D正确;
答案选C
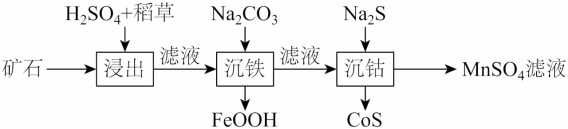
【2025黑吉辽蒙等级考】12. 化学需氧量(COD)是衡量水体中有机物污染程度的指标之一,以水样消耗氧化剂的量折算成消耗O2的量(单位为mg/L)来表示。碱性KMnO4不与Cl-反应,可用于测定含Cl⁻水样的COD,流程如图。
下列说法错误的是
A. Ⅱ中发生的反应有MnO2+2I-+4H+=Mn2++I2+2H2O
B. Ⅱ中避光、加盖可抑制I-被O2氧化及I2的挥发
C. Ⅲ中消耗的Na2S2O3越多,水样的COD值越高
D. 若Ⅰ中为酸性条件,测得含Cl-水样的COD值偏高
【答案】C
【解析】
【分析】I中KMnO4与水样中的有机物在碱性条件下反应得到MnO2,溶液中剩余有KMnO4,II中在酸性条件下KMnO4、MnO2与I-反应得到I2单质和Mn2+,III中生成的I2再用Na2S2O3滴定。
【详解】A.II中MnO4-和MnO2在酸性条件下与过量的KI反应得到I2和Mn2+,存在MnO2+2I-+4H+=Mn2++I2+2H2O,A正确;
B.II中避光防止I2升华挥发,加盖防止I-被氧气氧化,B正确;
C.整个反应中,KMnO4得电子生成Mn2+,有机物和碘离子失去电子数目与KMnO4得电子数目相等,III中消耗的Na2S2O3越多,说明生成的I2单质越多,也说明有机物消耗的KMnO4的量少,水样中的COD值越低,C错误;
D.若I中为酸性条件,Cl-会与KMnO4反应,水样中的COD值偏高,D正确;
答案选C。
【2025黑吉辽蒙等级考】13. 一种基于Cu2O的储氯电池装置如图,放电过程中a、b极均增重。若将b极换成Ag/AgCl电极,b极仍增重。关于图中装置所示电池,下列说法错误的是
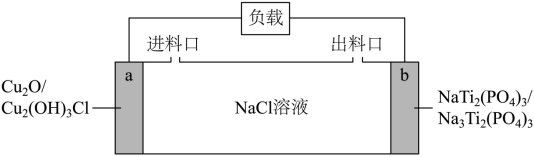
A. 放电时Na+向b极迁移
B. 该电池可用于海水脱盐
C. a极反应:Cu2O+2H2O+Cl--2e-=Cu2(OH)3Cl+H+
D. 若以Ag/AgCl电极代替a极,电池将失去储氯能力
【答案】D
【解析】
【分析】放电过程中a、b极均增重,这说明a电极是负极,电极反应式为Cu2O+2H2O+Cl--2e-=Cu2(OH)3Cl+H+,b电极是正极,电极反应式为NaTi2(PO4)3+2e-+2Na+=Na3Ti2(PO4)3,据此解答。
【详解】A.放电时b电极是正极,阳离子向正极移动,所以Na+向b极迁移,A正确;
B.负极消耗氯离子,正极消耗钠离子,所以该电池可用于海水脱盐,B正确;
C.a电极是负极,电极反应式为Cu2O+2H2O+Cl--2e-=Cu2(OH)3Cl+H+,C正确;
D.若以Ag/AgCl电极代替a极,此时Ag失去电子,结合氯离子生成氯化银,所以电池不会失去储氯能力,D错误;
答案选D。
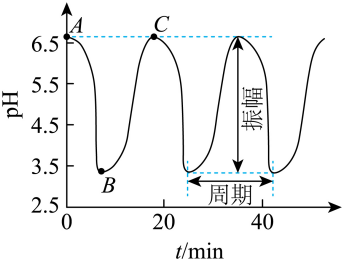
【2025黑吉辽蒙等级考】14. 一定条件下,“BrO3-- SO32-= [Fe(CN)6]4-- H+”4种原料按固定流速不断注入连续流动反应器中,体系pH-t振荡图像及涉及反应如下。其中AB段发生反应①~④,①②为快速反应。下列说法错误的是
① |
|
② |
|
③ |
|
④ |
|
⑤ |
|
A. 原料中c(H+)不影响振幅和周期
B. 反应④:3H2SO3+BrO3-=3SO42-+Br-+6H+
C. 反应①~④中,H+对SO32-的氧化起催化作用
D. 利用pH响应变色材料,可将pH振荡可视化
【答案】A
【解析】
【详解】A.根据图像可知氢离子浓度影响振幅大小,A错误;
B.反应④中亚硫酸被氧化,反应的离子方程式为3H2SO3+BrO3-=3SO42-+Br-+6H+,B正确;
C.由于①②为快速反应,而溴酸根离子直接氧化的是亚硫酸,所以反应①~④中,H+对SO32-的氧化起催化作用,C正确;
D.根据题干信息和图像可知利用pH响应变色材料,可将pH振荡可视化,D正确;
答案选A。
【2025黑吉辽蒙等级考】15. 室温下,将0.1molAgCl置于0.1mol/LNH4NO3溶液中,保持溶液体积和N元素总物质的量不变,pX-pH曲线如图,Ag++NH3 [Ag(NH3)]+和,Ag++2NH3
[Ag(NH3)]+和,Ag++2NH3![]() [Ag(NH3)2]+的平衡常数分别为K1和K2:NH4+的水解常数Kh(NH4+)=10-9.25。下列说法错误的是
[Ag(NH3)2]+的平衡常数分别为K1和K2:NH4+的水解常数Kh(NH4+)=10-9.25。下列说法错误的是
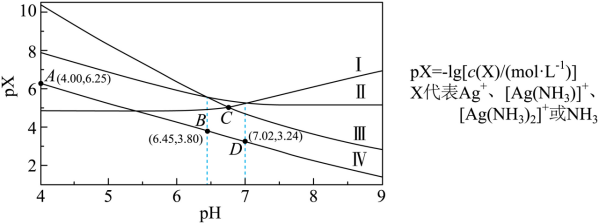
A. Ⅲ为[Ag(NH3)2]+的变化曲线 B. D点:c(NH4+)-c(OH-)>0.1-c(H+)
C.K1=103.24 D. C点:c(NH3)=10-3.52mol/L
【答案】B
【解析】
【分析】pH越小,酸性越强,Ag+浓度越大,氨气浓度越小,所以Ⅲ代表[Ag(NH3)2]+,Ⅱ代表[Ag(NH3)]+,Ⅳ代表NH3,Ⅰ代表Ag+,据此解答。
【详解】A.根据以上分析可知Ⅲ为[Ag(NH3)2]+的变化曲线,A正确;
B.硝酸铵为强酸弱碱盐,其溶液pH<7,图像pH增大至碱性,则外加了物质,又整个过程保持溶液体积和N元素总物质的量不变,则所加物质不是氨水,若不外加物质,则溶液中存在电荷守恒: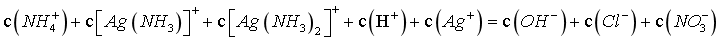 ,物料守恒:
,物料守恒: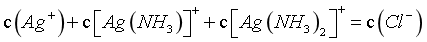 ,
,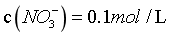 ,
,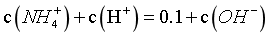 ,但外加了碱,设为NaOH,则c(Na+)+c(NH4+)+c(H+)=0.1+c(OH-),c(NH4+)-c(OH-)<0.1-c(H+),B错误;
,但外加了碱,设为NaOH,则c(Na+)+c(NH4+)+c(H+)=0.1+c(OH-),c(NH4+)-c(OH-)<0.1-c(H+),B错误;
C.根据图像可知D点时[Ag(NH3)]+和Ag+浓度相等,此时氨气浓度是10-3.24,根据Ag++NH3 [Ag(NH3)]+可知K1=103.24 ,C正确;
[Ag(NH3)]+可知K1=103.24 ,C正确;
D.C点时[Ag(NH3)2]+和Ag+浓度相等,B点时[Ag(NH3)2]+和[Ag(NH3)]+浓度相等,所以反应的Ag++2NH3 [Ag(NH3)2]+的平衡常数为103.8,因此K2=
[Ag(NH3)2]+的平衡常数为103.8,因此K2=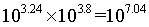 ,C点时[Ag(NH3)2]+和Ag+浓度相等,所以
,C点时[Ag(NH3)2]+和Ag+浓度相等,所以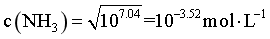 ,D正确;
,D正确;
答案选B。
二、非选择题:本题共4小题,共55分。
【2025黑吉辽蒙等级考】16. 某工厂采用如下工艺回收废渣(含有ZnS、PbSO4、FeS和CuCl)中的Zn、Pb元素。
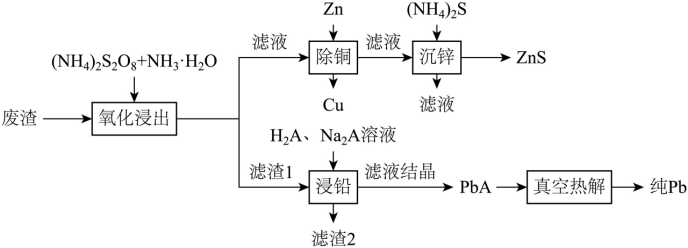
已知:①“氧化浸出”时,PbSO4不发生变化,ZnS转变为[Zn(NH3)4]2+;
②Ksp[Pb(OH)2]=10-14.8;
③酒石酸(记作H2A)结构简式为HOOC(CHOH)2COOH。
回答下列问题:
(1)H2A分子中手性碳原子数目为_______。
(2)“氧化浸出”时,过二硫酸根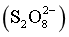 转变为_______(填离子符号)。
转变为_______(填离子符号)。
(3)“氧化浸出”时,浸出率随温度升高先增大后减小的原因为_______。
(4)“除铜”步骤中发生反应的离子方程式为_______。
(5)滤渣2中的金属元素为_______(填元素符号)。
(6)“浸铅”步骤,PbSO4和Na2A反应生成PbA。PbA产率随体系pH升高先增大的原因为_______,pH过高可能生成_______(填化学式)。
(7)290℃“真空热解”生成2种气态氧化物,该反应的化学方程式为_______。
【答案】(1)2 (2)SO42-
(3)温度升高,浸出速率增大,浸出率升高,温度过高时,NH3·H2O分解生成NH3逸出,且温度高时过二硫酸铵分解,造成浸出率减小
(4)Zn+[Cu(NH3)4]2+=[Zn(NH3)4]2++Cu
(5)Fe (6) ①. pH值升高,OH-浓度增大,平衡A2-+H2O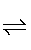 HA-+OH-逆向移动,A2-离子浓度增大,平衡PbSO4(s)+A2-
HA-+OH-逆向移动,A2-离子浓度增大,平衡PbSO4(s)+A2-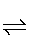 PbA+
PbA+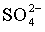 正向移动,PbA产率增大 ②. Pb(OH)2
正向移动,PbA产率增大 ②. Pb(OH)2
(7)Pb(OOC-CHOH-CHOH-COO)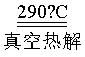 Pb+4CO↑+2H2O↑
Pb+4CO↑+2H2O↑
【解析】
【分析】废渣用(NH4)2S2O8和NH3·H2O氧化浸出过滤,滤液中有[Cu(NH3)4]2+和[Zn(NH3)4]2+,滤渣1有PbSO4和Fe(OH)3,滤液加Zn置换出Cu,除铜后的溶液加(NH4)2S沉锌,得到ZnS,滤渣1用H2A和Na2A浸铅后过滤,滤渣2含Fe元素,滤液经过结晶得到PbA,再真空热解得到纯Pb。
【小问1详解】
碳原子周围连接四个不同的原子或原子团为手性碳原子,H2A分子中手性碳原子有2个,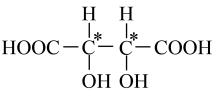 ;
;
【小问2详解】
“氧化浸出”时,过二硫酸根作氧化剂,过二硫酸根转变为SO42-;
【小问3详解】
“氧化浸出”时,温度升高,浸出速率增大,浸出率升高,温度过高时,NH3·H2O分解生成NH3逸出,且温度高时过二硫酸铵分解,造成浸出率减小;
【小问4详解】
加入Zn发生置换反应,从[Cu(NH3)4]2+置换出Cu单质,离子方程式为:Zn+[Cu(NH3)4]2+=[Zn(NH3)4]2++Cu;
【小问5详解】
根据分析,滤渣1有Fe(OH)3和PbSO4,用H2A和Na2A浸铅后过滤,滤渣2含Fe元素的沉淀;
【小问6详解】
“浸铅”步骤发生PbSO4(s)+A2- PbA+SO42-,Na2A溶液中存在A2-+H2O
PbA+SO42-,Na2A溶液中存在A2-+H2O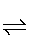 HA-+OH-,pH值升高,OH-浓度增大,平衡A2-+H2O
HA-+OH-,pH值升高,OH-浓度增大,平衡A2-+H2O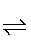 HA-+OH-逆向移动,A2-离子浓度增大,平衡PbSO4(s)+A2-
HA-+OH-逆向移动,A2-离子浓度增大,平衡PbSO4(s)+A2-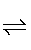 PbA+SO42-正向移动,PbA产率增大;pH过高时,OH-浓度过大,会生成Pb(OH)2沉淀,造成PbA产率降低;
PbA+SO42-正向移动,PbA产率增大;pH过高时,OH-浓度过大,会生成Pb(OH)2沉淀,造成PbA产率降低;
【小问7详解】
290℃“真空热解”PbA即Pb(OOC-CHOH-CHOH-COO)生成Pb单质和2种气态氧化物为CO和H2O,反应的化学方程式为:Pb(OOC-CHOH-CHOH-COO)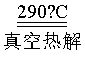 Pb+4CO↑+2H2O↑。
Pb+4CO↑+2H2O↑。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。一、选择题:本大题共 16 小题,共 44 分。第 1- 题,每小题 2 分;第 11-16 小题,每...
一、选择题:本题共 7 小题,每小题 6 分,共 42 分。在每小题给出的 4 个选项中,只...
一、选择题 ( 本大题共 16 小题,每小题 3 分,共 48 分。每小题列出的四个备选项中只...
1. 定窑是宋代五大名窑之一,其生产的白瓷闻名于世。下列说法正确的是 A. 传统陶瓷是...
可能用到的相对原子质量: H-1 C-12 N-14O-16 Mg-24 S-32 第一部分 本部分共 14 小题...
一位资深的班主任曾说:“家长与学校配合得越好,教育越会成功。我可以非常负责任的说...