
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
【2025湖北等级考】17. 化合物G是某药物的关键原料,合成路线如下:
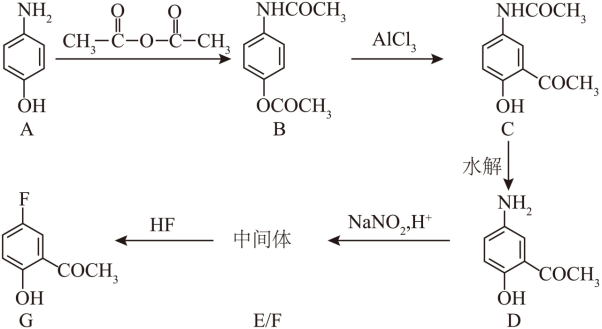
回答下列问题:
(1)化合物A分子内含氧官能团的名称为_______。
(2)化合物A→B的反应类型为_______反应。B的核磁共振氢谱有_______组峰。
(3)能用于分离化合物B和C的试剂为_______(填标号)。
a.NaHCO3水溶液 b.Na2CO3水溶液 c.Na2SO4水溶液
(4)C→D的反应方程式为_______。在A的氮原子上引入乙酰基(CH3CO-)的作用是_______
(5)化合物D与间的反应方程式:
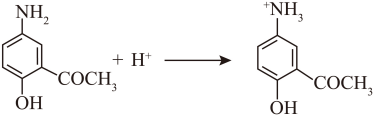
用类比法,下列反应中X的结构简式为_______。

(6)E存在一种含羰基异构体F,二者处于快速互变平衡。F与HF反应可生成G,写出F的结构简式_______。
【答案】(1)羟基 (2) ①. 取代 ②. 5
(3)b (4) ①. 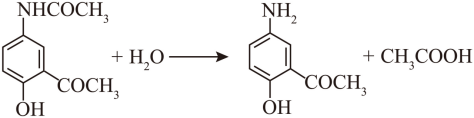 ②. 保护氨基
②. 保护氨基
(5)+N=O (6)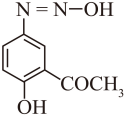
【解析】
【分析】A与乙酸酐发生取代反应生成B,B在AlCl3作用下发生反应转化为C,C中酰胺基水解生成D,D在H+、NaNO2作用下生成E为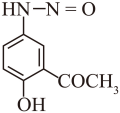 ,E与HF发生取代反应转化为G,据此解答。
,E与HF发生取代反应转化为G,据此解答。
【小问1详解】
化合物A分子内含氧官能团名称为羟基;
【小问2详解】
A中氨基与羟基与乙酸酐发生取代反应生成B;B的核磁共振氢谱图共有5组峰,如图所示: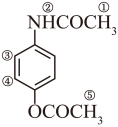 ;
;
【小问3详解】
B和C的不同之处在于,B的官能团是酯基,C的官能团是羟基和酮羰基,两种溶液均不能和碳酸氢钠溶液反应,排除a,C中酚羟基能和碳酸钠溶液反应生成钠盐可溶于水,而B不能和碳酸钠反应,再通过分液即可分离B和C,b选;两种溶液均不能和硫酸钠溶液反应,排除c,故选b;
【小问4详解】
C→D的反应是酰胺基的水解反应,化学方程式为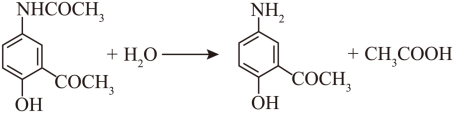 ;A→B引入CH3CO-,C→D重新生成氨基,作用是保护氨基;
;A→B引入CH3CO-,C→D重新生成氨基,作用是保护氨基;
【小问5详解】
根据电荷守恒推断,X带一个单位正电,根据原子守恒推断,X含有一个N原子和一个O原子,则X的结构简式为+N=O;
【小问6详解】
E的结构简式为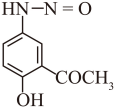 ,其存在一种含羰基的异构体F,二者处于快速互变平衡,则F的结构简式为
,其存在一种含羰基的异构体F,二者处于快速互变平衡,则F的结构简式为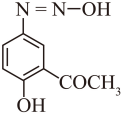 。
。
【2025湖北等级考】18. 某小组在探究Cu2+的还原产物组成及其形态过程中,观察到的实验现象与理论预测有差异。根据实验描述,回答下列问题:
(1)向2mL10%NaOH溶液加入5滴5%CuSO4溶液,振荡后加入2mL10%葡萄糖溶液,加热。
①反应产生的砖红色沉淀为_______(写化学式),葡萄糖表现出_______(填“氧化”或“还原”)性。
②操作时,没有加入葡萄糖溶液就加热,有黑色沉淀生成。用化学反应方程式说明该沉淀产生的原因:_______。
(2)向20mL0·5mol/L CuSO4溶液中加入Zn粉使蓝色完全褪去,再加入盐酸并加热至溶液中无气泡产生为止。过滤得固体,洗涤并真空干燥。
①加入盐酸的目的是_______
②同学甲一次性加入1.18gZn粉,得到0.78g红棕色固体,其组成是_______(填标号)。
a.Cu b.Cu包裹Zn c.CuO d.Cu和Cu2O
③同学乙搅拌下分批加入1.18g Zn粉,得到黑色粉末X。分析结果表明,X中不含Zn和Cu(Ⅰ)。关于X 组成提出了三种可能性:Ⅰ CuO ;Ⅱ CuO 和Cu;Ⅲ Cu,开展了下面2个探究实验:
组成提出了三种可能性:Ⅰ CuO ;Ⅱ CuO 和Cu;Ⅲ Cu,开展了下面2个探究实验:
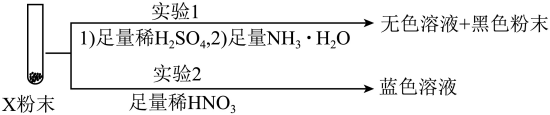
由实验结果可知,X的组成是_______(填“Ⅰ”“Ⅱ”或“Ⅲ”)。从物质形态角度分析,X为黑色的原因是_______。
【答案】(1) ①. Cu2O ②. 还原 ③.Cu(OH)2 CuO+H2O
CuO+H2O
(2) ①. 除去过量的锌粉 ②. b ③. Ⅲ ④. 光线进入后被多次反射吸收,所以呈黑色
【解析】
【分析】(1)向2mL10%NaOH溶液加入5滴5%CuSO4溶液,制得新制氢氧化铜悬浊液,振荡后加入2mL10%葡萄糖溶液,加热,新制氢氧化铜悬浊液和葡萄糖中的醛基反应;
(2)向20mL0·5mol/L CuSO4溶液中加入Zn粉使蓝色完全褪去,Cu2+全部被还原,再加入盐酸并加热至溶液中无气泡产生为止,过量的Zn粉全部转化为Zn2+,过滤得固体,洗涤并真空干燥,该固体是Cu2+的还原产物,可能含Cu、Cu2O等。
【小问1详解】
①向2mL10%NaOH溶液加入5滴5%CuSO4溶液制得新制氢氧化铜悬浊液,振荡后加入2mL10%葡萄糖溶液,加热,新制氢氧化铜悬浊液与葡萄糖中的醛基反应产生的砖红色沉淀为Cu2O,Cu被葡萄糖从+2价还原为+1价,葡萄糖表现出还原性;
②操作时,没有加入葡萄糖溶液就加热,有黑色沉淀生成,该黑色沉淀为CuO,用化学反应方程式说明该沉淀产生的原因:Cu(OH)2 CuO+H2O ;
CuO+H2O ;
【小问2详解】
①由题干加入盐酸并加热至溶液中无气泡产生为止可知加入盐酸的作用是除去过量的锌粉;
②先加Zn粉、后加盐酸,得到固体为红棕色,则一定有Cu(Cu2O和HCl发生歧化反应生成Cu),20mL 0.5mol/LCuSO4中n(Cu2+)=0.5mol/L×20mL=0.01mol,Cu的最大物质的量为0.01mol,质量为0.64g,生成Cu2O的最大质量为0.72g,实际固体质量为0.78g:
a.若只有Cu,则固体质量应小于等于0.64g,a不符题意;
b.若是Cu包裹Zn,则0.64<固体质量<1.18g,b符合题意;
c.若是CuO,则不可能为红棕色,c不符题意;
d.若是Cu和Cu2O,固体质量应介于0.64g—0.72g之间,d不符题意;
选b;
③实验1得到的溶液呈无色,说明一定无CuO,那么X的组成只能是Cu,选Ⅲ;从物质形态角度分析,X为黑色的原因是金属固体Cu呈粉末状时,光线进入后被多次反射吸收,所以呈黑色。
【2025湖北等级考】19.CaH2(s) 粉末可在较低温度下还原Fe2O3(s)。回答下列问题:
(1)已知一定温度下:
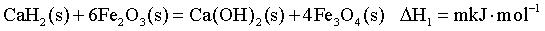
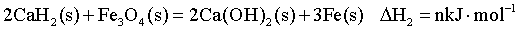
则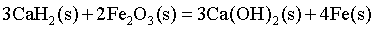 的
的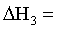 _______
_______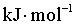 (用m和n表示)。
(用m和n表示)。
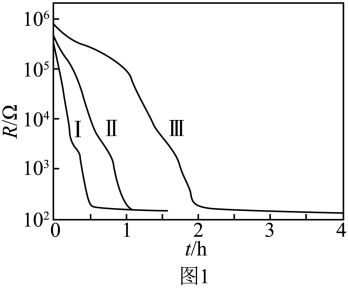
(2)图1分别是260℃、280℃和300℃下CaH2(s)还原Fe2O3(s)过程中反应体系电阻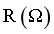 随反应时间
随反应时间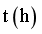 变化的曲线,可用_______(填标号)表示反应的快慢。
变化的曲线,可用_______(填标号)表示反应的快慢。
a.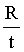 b.
b.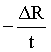 c.
c.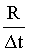 d.
d.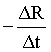
(3)图1中曲线_______(填“Ⅰ”“Ⅱ”或“Ⅲ”)对应的反应温度最高。
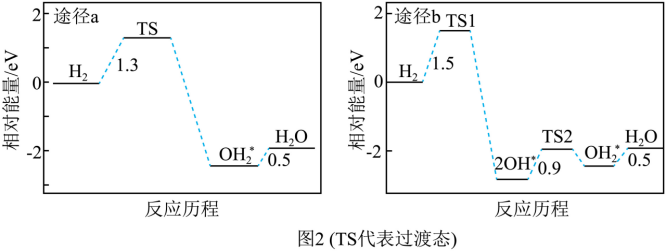
(4)研究发现CaH2(s)对Fe2O3(s)的还原性主要来自于其产生的H2。一般认为H2在Fe2O3表面被氧化成H2O有两种可能途径,图2是理论计算得到的相对能量变化图,据此推测途径_______(填“a”或“b”)是主要途径。
(5)CaH2(s)产生H2的可能反应:①CaH2(s)=Ca(s)+H2(g)或②CaH2(s)+2H2O(g)=Ca(OH)2(s)+2H2(g)。将CaH2(s)放在含微量水的N2气流中,在200℃至300℃的升温过程中固体质量一直增加,由此可断定H2的来源之一是反应_______(填“①”或“②”)。若要判断另一个反应是否是H2的来源,必须进行的实验是_______。
(6)已知3H2(g)+Fe2O3(s) 3H2O(g)+2Fe(s)。研究表明,在相同温度下,用CaH2(s)还原Fe2O3(s)比直接用H2(g)还原更有优势,从平衡移动原理角度解释原因:_______。
3H2O(g)+2Fe(s)。研究表明,在相同温度下,用CaH2(s)还原Fe2O3(s)比直接用H2(g)还原更有优势,从平衡移动原理角度解释原因:_______。
【答案】(1)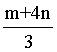
(2)d (3)Ⅰ
(4)a (5) ①. ② ②. 将CaH2(s)放在不含水的N2气流中加热升温,看固体质量是否在减小
(6)CaH2(s)消耗H2O(g)同时产生H2(g),H2O(g)的浓度减小,H2(g)的浓度增大均有利于平衡3H2(g)+Fe2O3(s) 3H2O(g)+2Fe(s)正向移动,提高Fe的产率
3H2O(g)+2Fe(s)正向移动,提高Fe的产率
【解析】
【小问1详解】
①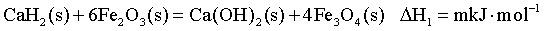
②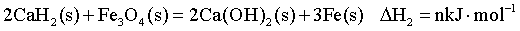
③
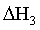
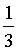 ×①+
×①+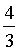 ×②得到反应③,根据盖斯定律可知
×②得到反应③,根据盖斯定律可知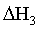 =
=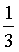 ×
×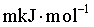 +
+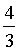 ×
×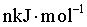 =
=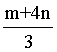
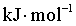 ;
;
【小问2详解】
随着铁的生成,电阻变小,可用单位时间内电阻的变化量来表示反应速率,即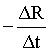 ,选d;
,选d;
【小问3详解】
其它条件相同,温度越高,反应速率越快,曲线Ⅰ电阻变化最快,故曲线Ⅰ对应的反应温度最高;
【小问4详解】
由图可知途径a中能垒为1.3eV,比途径b中小,故途径a反应速率更快,途径a是主要途径;
【小问5详解】
固体质量一直增加,则氢气的来源之一是反应②;若要判断另一个反应是否是H2的来源,必须进行的实验是:将CaH2(s)放在不含水的N2气流中加热升温,看固体质量是否在减小;
【小问6详解】
在相同温度下,用CaH2(s)还原Fe2O3(s)比直接用H2(g)还原更有优势,从平衡移动原理角度解释原因:CaH2(s)消耗H2O(g)同时产生H2(g),H2O(g)的浓度减小,H2(g)的浓度增大均有利于平衡3H2(g)+Fe2O3(s) 3H2O(g)+2Fe(s)正向移动,提高Fe的产率。
3H2O(g)+2Fe(s)正向移动,提高Fe的产率。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
一、选择题:本题共 14 小题,每小题 3 分,共 42 分。在每小题...
一、选择题:本大题共 16 小题,共 44 分。第 1- 题,每小题 2 分...
一、选择题:本题共 7 小题,每小题 6 分,共 42 分。在每小题给...
一、选择题 ( 本大题共 16 小题,每小题 3 分,共 48 分。每小题...
1. 定窑是宋代五大名窑之一,其生产的白瓷闻名于世。下列说法...
可能用到的相对原子质量: H-1 C-12 N-14O-16 Mg-24 S-32 第一部分 本部...