
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
【2025河北等级考】1. 河北省古建筑数量大,历史跨度长,种类齐全,在我国建筑史上占有非常重要的地位。下列古建筑组件主要成分属于有机物的是
|
|
|
|
A.基石 | B.斗拱 | C.青瓦 | D.琉璃 |
A. A B. B C. C D. D
【答案】B
【解析】
【详解】A.古建筑中的基石一般使用石质材料,常用的石材有花岗岩、青石等,花岗岩的主要成分是硅酸盐,青石的主要成分是CaCO3,均属于无机物,A错误;
B.斗拱是由木材制成的,木材的主要成分是纤维素,属于有机物,B正确;
C.青瓦是由黏土烧制而成的传统建筑材料,黏土的主要成分为含水的铝硅酸盐,属于无机物,C错误;
D.琉璃的主要成分是二氧化硅,属于无机物,D错误;
故选B。
【2025河北等级考】2. 下列不符合实验安全要求的是
A. 酸、碱废液分别收集后直接排放 B. 进行化学实验时需要佩戴护目镜
C. 加热操作时选择合适的工具避免烫伤 D. 乙醇应存放在阴凉通风处,远离火种
【答案】A
【解析】
【详解】A.酸、碱废液需中和处理达标后才能排放,直接排放会污染环境,不符合安全要求,A错误;
B.实验时佩戴护目镜是防止化学试剂溅入眼睛的必要防护措施,B正确;
C.选择合适的加热工具如坩埚钳,可避免直接接触高温物体导致烫伤,C正确;
D.乙醇易燃,存放于阴凉通风处并远离火源是防止火灾的安全措施,D正确;
故选A。
【2025河北等级考】3. 高分子材料在生产、生活中得到广泛应用。下列说法错误的是
A. ABS高韧性工程塑料用于制造汽车零配件 B. 聚氯乙烯微孔薄膜用于制造饮用水分离膜
C. 聚苯乙烯泡沫用于制造建筑工程保温材料 D. 热固性酚醛树脂用于制造集成电路的底板
【答案】B
【解析】
【详解】A.ABS高韧性工程塑料常用于汽车零配件,因其良好的机械性能,A正确;
B.聚氯乙烯(PVC)含塑化剂等添加剂,可能释放有害物质,不适合用于饮用水分离膜(常用材料如聚丙烯),B错误;
C.聚苯乙烯泡沫具有优良保温性能,广泛用于建筑工程保温,C正确;
D.热固性酚醛树脂耐高温、绝缘性好,适合制造集成电路底板,D正确;
故选B。
【2025河北等级考】4. 设NA是阿伏加德罗常数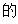 值,下列说法错误的是
值,下列说法错误的是
A. 18gH2O晶体内氢键的数目为2NA
B.1L mol/L的NaF溶液中阳离子总数为NA
C. 28g环己烷和戊烯的混合物中碳原子的数目为2NA
D. 铅酸蓄电池负极增重96g,理论上转移电子数为2NA
【答案】B
【解析】
【详解】A.每个水分子在冰中形成4个氢键,但每个氢键被两个分子共享,故每个分子贡献2个氢键。18gH2O为1mol,氢键数目为2NA,A正确;
B.NaF溶液中阳离子包括Na+和H+。Na+为1mol,根据电荷守恒:c(Na+)+c(H+)=c(F-)+c(OH-),钠离子不会水解,并且水电离出少量氢离子,则有n(Na+)+n(H+)>1mol,所以阳离子总数大于NA,B错误;
C.环己烷和戊烯的最简式均为CH2,28g混合物含2mol CH2单元,对应2mol碳原子,碳原子数目为2NA,C正确;
D.铅酸蓄电池负极反应为Pb+SO42--2e-=PbSO4。增重96g对应生成1molPbSO4,转移2mol电子,数目为:2NA,D正确;
故选B。
【2025河北等级考】5. 下列化学用语表述正确的是
A. 中子数为12的氖核素: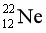 B. 氯化镁的电子式:
B. 氯化镁的电子式: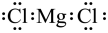
C. 甲醛分子的球棍模型: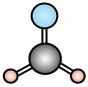 D.CO32-的价层电子对互斥模型:
D.CO32-的价层电子对互斥模型: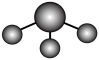
【答案】C
【解析】
【详解】A.氖原子的质子数为10,中子数为12,故氖核素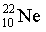 ,A错误;
,A错误;
B.氯化镁为离子化合物,电子式为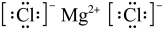 ,B错误;
,B错误;
C.甲醛(HCHO)分子 平面三角形结构,球棍模型中原子大小、连接方式应与实际结构相符。甲醛中C原子连接2个H原子和1个O原子,且为平面结构,题中模型符合甲醛分子结构特点,C正确;
平面三角形结构,球棍模型中原子大小、连接方式应与实际结构相符。甲醛中C原子连接2个H原子和1个O原子,且为平面结构,题中模型符合甲醛分子结构特点,C正确;
D.对于CO32-,中心C原子的价层电子对数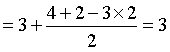 ,孤电子对数为0,价层电子对互斥模型应为平面三角形 ,D错误;
,孤电子对数为0,价层电子对互斥模型应为平面三角形 ,D错误;
故选C。
【2025河北等级考】6. 丁香挥发油中含丁香色原酮(K)、香草酸(M),其结构简式如下:
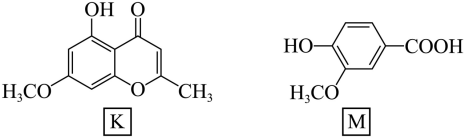
下列说法正确的是
A. K中含手性碳原子 B. M中碳原子都是sp2杂化
C. K、M均能与NaHCO3反应 D. K、M共有四种含氧官能团
【答案】D
【解析】
【详解】A.由图知,K中环上碳原子均为sp2杂化,饱和碳原子均为甲基碳原子,所以不含手性碳原子,A错误;
B.M中环上碳原子和羧基上的碳原子均为sp2杂化,甲基碳原子为sp3杂化,B错误;
C.由于酸性:羧酸>碳酸>苯酚>HCO3-,所以K中的酚羟基不能与NaHCO3溶液反应,K中不含能与NaHCO3溶液反应的官能团,M中羧基可与NaHCO3溶液反应,C错误;
D.K、M 中共有羟基、醚键、羰基、羧基四种含氧官能团,D正确;
故选D。
【2025河北等级考】7. 如图所示装置(加热、除杂和尾气处理装置任选)不能完成相应气体的制备和检验的是
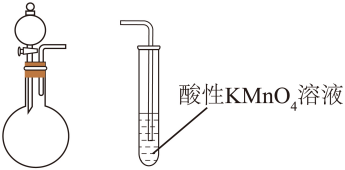
A. 电石与饱和NaCl溶液 B.Na2SO3固体与70%的浓H2SO4
C. 大理石与稀HCl D. Al2S3固体与水
【答案】C
【解析】
【详解】A.电石与饱和NaCl溶液反应制备C2H2,C2H2中含有不饱和键,可使酸性KMnO4溶液褪色,能完成相应气体的制备和检验,A不符合题意;
B.Na2SO3固体与 70%的浓H2SO4反应制备SO2,SO2可使酸性KMnO4溶液褪色,能完成相应气体的制备和检验,B不符合题意;
C.大理石与稀HCl反应制备CO2,CO2不可使酸性KMnO4溶液褪色,不能完成相应气体的制备和检验,C符合题意;
D.Al2S3固体遇水水解生成Al(OH)3和H2S,H2S可使酸性KMnO4溶液褪色,能完成相应气体的制备和检验,D不符合题意;
故选C。
【2025河北等级考】8. 化学研究应当注重宏观与微观相结合。下列宏观现象与微观解释不符的是
选项 | 宏观现象 | 微观解释 |
A | 氮气稳定存在于自然界中 | 氮分子中存在氮氮三键,断开该共价键需要较多的能量 |
B | 苯不能使溴的CCl4溶液褪色 | 苯分子中碳原子形成了稳定的大π键 |
C | 天然水晶呈现多面体外形 | 原子在三维空间里呈周期性有序排列 |
D | 氯化钠晶体熔点高于氯化铝晶体 | 离子晶体中离子所带电荷数越少,离子半径越大,离子晶体熔点越低 |
A. A B. B C. C D. D
【答案】D
【解析】
【详解】A.氮气的稳定性源于氮分子中的三键,键能高难以断裂,A正确;
B.苯因大π键结构稳定,难以与溴发生加成或取代,B正确;
C.水晶的规则外形由原子三维有序排列(晶体结构)导致,C正确;
D.氯化钠熔点高于氯化铝的真实原因是氯化铝为分子晶体而非离子晶体,选项中将二者均视为离子晶体并用离子电荷和半径解释,不符合实际,D错误;
故选D。
【2025河北等级考】9. W、X、Y、Z为四种短周期非金属元素,W原子中电子排布已充满的能级数与最高能级中的电子数相等,X与W同族,Y与X相邻且Y原子比X原子多一个未成对电子,Z位于W的对角线位置。下列说法错误的是
A. 第二电离能:X<Y B. 原子半径:Z<W
C. 单质沸点:Y<Z D. 电负性:W<Z
【答案】A
【解析】
【分析】W、X、Y、Z为四种短周期非金属元素,W原子中电子排布已充满的能级数与最高能级中的电子数相等,则W价电子排布式可能是:1s22s22p2或1s22s22p63s23p4,若W是C,X与W同族,则X是Si,Y与X相邻且Y原子比X原子多一个未成对电子,则Y是P,Z位于W的对角线位置,则满足条件的Z是P,与Y重复;故W是S;X与W同族,则X是O;Y与X相邻且Y原子比X原子多一个未成对电子,则Y是N;Z位于W的对角线位置,则Z是F。
【详解】A.O的第二电离能高于N,因为O+的电子构型为2p3(半充满),失去电子需更高能量,而N+的电子构型为2p2,失去电子相对容易,因此X(O)的第二电离能大于Y(N),A错误;
B.同主族从上到下,原子半径变大,同周期,从左到右原子半径变小,F(Z)位于第二周期,S(W)位于第三周期,原子半径S>O>F,即:Z<W,B正确;
C.N2与F2都是分子晶体,F2范德华力大,沸点高,C正确;
D.同主族从上到下,电负性逐渐减小,O的电负性大于S,D正确;
故选A。
【2025河北等级考】10. 科研工作者设计了一种用于废弃电极材料LixCoO2(x<1)再锂化的电化学装置,其示意图如下:
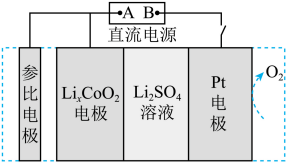
已知:参比电极的作用是确定LixCoO2再锂化为LiCoO2的最优条件,不干扰电极反应。下列说法正确的是
A. LixCoO2电极上发生的反应:LixCoO2+xe-+xLi+=LiCoO2
B. 产生标准状况下5.6LO2时,理论上可转化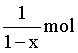 的LixCoO2
的LixCoO2
C. 再锂化过程中,SO42-向LixCoO2电极迁移
D. 电解过程中,阳极附近溶液pH升高
【答案】B
【解析】
【分析】由装置图可知,该装置中有直流电源,为电解池,则LixCoO2(x<1) 转化为LiCoO2过程中,Co元素化合价由+(4-x)降为+3,LixCoO2得电子发生还原反应,为阴极,电极反应式为LixCoO2+(1-x)e-+(1-x)Li+=LiCoO2,Pt电极为阳极,失电子,发生还原反应,电极反应式为2H2O-4e-=O2↑+4H+,据此回答。
【详解】A.由分析知,LixCoO2电极上发生的反应:LixCoO2+(1-x)e-+(1-x)Li+=LiCoO2,A错误;
B.由电极反应式可知,产生标准状况下5.6L(即0.25 mol) O2时转移1 mol 电子,理论上转化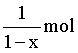 的LixCoO2,B正确;
的LixCoO2,B正确;
C.SO42-为阴离子,应向阳极移动,即向Pt电极迁移,C错误;
D.由阳极电极反应式可知,电解过程中,阳极产生H+、消耗H2O,酸性增强,则阳极附近pH降低,D错误;
故选B。
【2025河北等级考】11.SmCok(k>1) 是一种具有优异磁性能的稀土永磁材料,在航空航天等领域中获得重要应用。SmCok的六方晶胞示意图如下,晶胞参数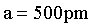 、
、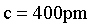 ,M、N原子的分数坐标分别为
,M、N原子的分数坐标分别为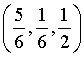 、
、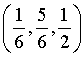 。设
。设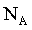 是阿伏加德罗常数的值。
是阿伏加德罗常数的值。
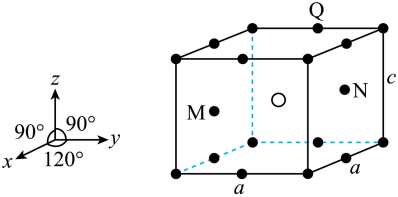
下列说法错误的是
A. 该物质的化学式为SmCo5 B. 体心原子的分数坐标为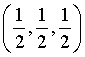
C. 晶体的密度为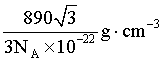 D. 原子Q到体心的距离为
D. 原子Q到体心的距离为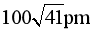
【答案】D
【解析】
【详解】A.由晶胞图知,白球位于体心,晶胞中数目为1,黑球位于顶角、棱心、体内,晶胞中数目为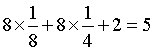 ,结合题意知,白球为Sm、黑球为Co,该物质化学式为SmCo5,A正确;
,结合题意知,白球为Sm、黑球为Co,该物质化学式为SmCo5,A正确;
B.体心原子位于晶胞的中心,其分数坐标为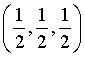 ,B正确;
,B正确;
C.每个晶胞中含有1个“SmCo5”,晶胞底面为菱形,晶胞体积为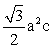 ,则晶体密度为
,则晶体密度为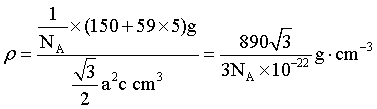 ,C正确;
,C正确;
D.原子Q的分数坐标为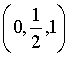 ,由体心原子向上底面作垂线,垂足为上底面面心,连接该面心与原子Q、体心与原子Q可得直角三角形
,由体心原子向上底面作垂线,垂足为上底面面心,连接该面心与原子Q、体心与原子Q可得直角三角形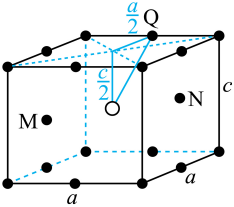 ,则原子Q到体心的距离
,则原子Q到体心的距离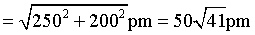 ,D错误;
,D错误;
故选D。
【2025河北等级考】12. 氮化镓(GaN)是一种重要的半导体材料,广泛应用于光电信息材料等领域,可利用反应Ga2O3(s)+2NH3(g) 2GaN(s)+3H2O(g)制备。反应历程(TS代表过渡态)如下:
2GaN(s)+3H2O(g)制备。反应历程(TS代表过渡态)如下:
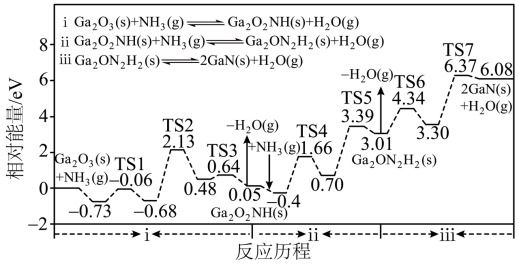
下列说法错误的是
A. 反应ⅰ是吸热过程
B. 反应ⅱ中H2O(g)脱去步骤的活化能为2.69eV
C. 反应ⅲ包含2个基元反应
D. 总反应的速控步包含在反应ⅱ中
【答案】D
【解析】
【详解】A.观察历程图可知,反应ⅰ中Ga2O3(s)+2NH3(g)的相对能量为0,经TS1、TS2、TS3完成反应,生成Ga2O2NH(s)和H2O,此时的相对能量为0.05eV,因此体系能量在反应中增加,则该反应为吸热过程,A正确;
B.反应ⅱ中因H2O(g)脱去步骤需要经过TS5,则活化能为0.70eV与TS5的相对能量差,即3.39eV-0.70eV=2.69eV,B正确;
C.反应ⅲ从Ga2O2NH(s)生成2GaN(s)+H2O(g)经历过渡态TS6、TS7,说明该反应分两步进行,包含2个基元反应,C正确;
D.整反应历程中,活化能最高的步骤是反应ⅲ中的TS7对应得反应步骤(活化能为3.07eV),所以总反应的速控步包含在反应ⅲ中,D错误;
故选D。
【2025河北等级考】13. 下列实验操作及现象能得出相应结论的是
选项 | 实验操作及现象 | 结论 |
A | 向盛有NO2与N2O4的恒压密闭容器中通入一定体积的N2,最终气体颜色变浅 | 化学平衡向NO2减少的方向移动 |
B | 以K2CrO4为指示剂,用AgNO3标准溶液滴定溶液中的Cl-,先出现白色沉淀,后出现砖红色沉淀 | Ksp(AgCl)<Ksp(Ag2CrO4) |
C | 向盛有2mL FeCl3溶液的试管中加入过量铁粉,充分反应后静置,滴加KSCN溶液无明显变化;静置,取上层清液滴加几滴氯水,溶液变红 | Fe2+具有还原性 |
D | 向盛有2mL饱和Na₂SO4溶液的试管中滴加鸡蛋清溶液,振荡,有沉淀析出;加蒸馏水稀释,再振荡,沉淀溶解 | 蛋白质沉淀后活性改变 |
A. A B. B C. C D. D
【答案】C
【解析】
【详解】A.恒压条件下通入N2,容器体积增大,NO2和N2O4的浓度均降低,平衡向NO2增加颜色的方向移动,A错误;
B.AgCl的Ksp(1.8×10-10)小于Ag2CrO4的Ksp(1.1×10-12),但AgCl先沉淀是因为其溶度积更小,B错误;
C.Fe3+被Fe还原为Fe2+,滴加氯水后Fe2+被氧化为Fe3+,证明Fe2+具有还原性,C正确;
D.饱和Na₂SO4使蛋白质盐析,加水后沉淀溶解,说明未破坏蛋白质活性,D错误;
故选C。
【2025河北等级考】14. 已知Cu2+和L3-结合形成两种配离子[CuL]-和[CuL2]4-常温下,0.100mol/L的H3L和0.002mol/L的CuSO4混合溶液中,HL2-和L3-的浓度对数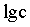 (实线)、含铜微粒的分布系数
(实线)、含铜微粒的分布系数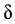 (虚线)[例如
(虚线)[例如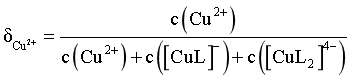 ]与溶液pH的关系如图所示:
]与溶液pH的关系如图所示:
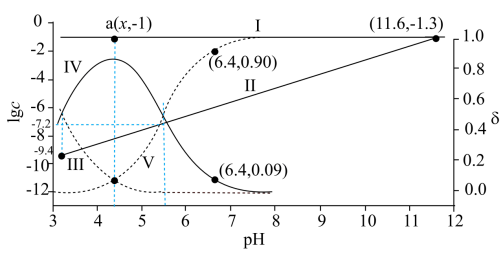
下列说法错误的是
A.Cu2++L3- [CuL]-,K=109.4
[CuL]-,K=109.4
B. HL2- H++L3-,K=10-11.6
H++L3-,K=10-11.6
C. 图中a点对应的pH=4.2
D. 当pH=6.4时,体系中c(HL2-)>c([CuL2]4-)>c([CuL]-)>c(L3-)
【答案】C
【解析】
【分析】HL2-和L3-之间存在HL2- H++L3-转化关系,则pH较小时,平衡逆向移动,以HL2-为主,则
H++L3-转化关系,则pH较小时,平衡逆向移动,以HL2-为主,则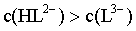 ,
,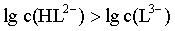 ,则曲线I代表
,则曲线I代表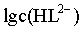 ,曲线II代表
,曲线II代表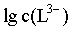 ,随着pH增大,HL2-
,随着pH增大,HL2- H++L3-正向移动,c(L3-)增大,Cu2+和L3-结合形成配离子
H++L3-正向移动,c(L3-)增大,Cu2+和L3-结合形成配离子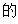 反应依次为
反应依次为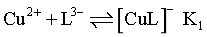 、
、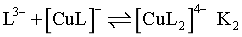 ,因此随pH增大,
,因此随pH增大,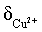 持续减小,为曲线III,
持续减小,为曲线III,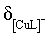 ,先增大后减小,为曲线IV,
,先增大后减小,为曲线IV,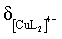 一直增大,为曲线V,据此回答。
一直增大,为曲线V,据此回答。
【详解】A.曲线III和曲线IV的交点代表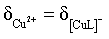 ,即
,即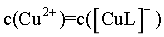 ,由图可知,此时
,由图可知,此时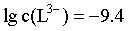 ,带入平衡表达式得
,带入平衡表达式得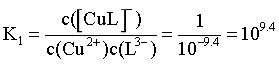 ,A正确;
,A正确;
B.曲线I和曲线II的交点代表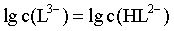 ,即
,即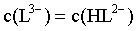 ,此时pH=11.6,带入平衡常数表达式得
,此时pH=11.6,带入平衡常数表达式得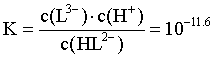 ,B正确;
,B正确;
C.曲线IV和曲线V得交点代表,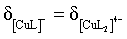 ,即
,即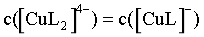 ,此时
,此时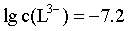 ,可得
,可得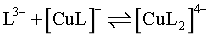 的平衡常数
的平衡常数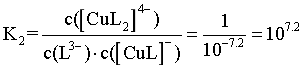 ,a点时,
,a点时,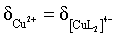 ,带入
,带入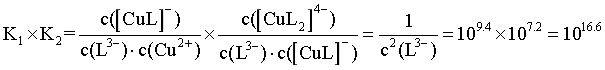 ,解得
,解得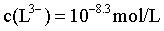 ,且a点对应
,且a点对应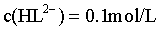 ,带入HL2-
,带入HL2- H++L3-的平衡常数
H++L3-的平衡常数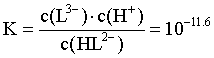 ,计算得
,计算得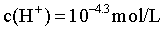 ,故pH=4.3,C错误;
,故pH=4.3,C错误;
D.当pH=6.4时,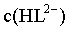 最大,接近
最大,接近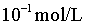 ,结合B项中平衡常数可计算得
,结合B项中平衡常数可计算得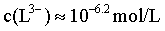 ,
,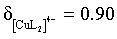 ,
,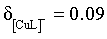 结合Cu 元素守恒知,
结合Cu 元素守恒知,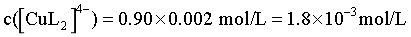 ,
,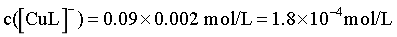 ,因此体系中c(HL2-)>c([CuL2]4-)>c([CuL]-)>c(L3-),D正确;
,因此体系中c(HL2-)>c([CuL2]4-)>c([CuL]-)>c(L3-),D正确;
故选C。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。一、选择题:本大题共 16 小题,共 44 分。第 1- 题,每小题 2 分;第 11-16 小题,每...
一、选择题:本题共 7 小题,每小题 6 分,共 42 分。在每小题给出的 4 个选项中,只...
一、选择题 ( 本大题共 16 小题,每小题 3 分,共 48 分。每小题列出的四个备选项中只...
1. 定窑是宋代五大名窑之一,其生产的白瓷闻名于世。下列说法正确的是 A. 传统陶瓷是...
可能用到的相对原子质量: H-1 C-12 N-14O-16 Mg-24 S-32 第一部分 本部分共 14 小题...
一位资深的班主任曾说:“家长与学校配合得越好,教育越会成功。我可以非常负责任的说...