
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
二、非选择题:本题共4题,共58分。
【2025河北等级考】15. 氢碘酸常用于合成碘化物。某化学兴趣小组用如图装置(夹持装置等略)制备氢碘酸。
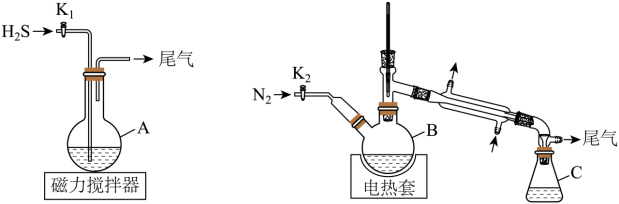
步骤如下:
ⅰ.在A中加入150mLH2O和127g I2,快速搅拌,打开K1通入H2S,反应完成后,关闭K1,静置、过滤得滤液;
ⅱ.将滤液转移至B中,打开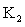 通入N2,接通冷凝水,加热保持微沸,直至H2S除尽;
通入N2,接通冷凝水,加热保持微沸,直至H2S除尽;
ⅲ.继续加热蒸馏,C中收集沸点为125~127℃间的馏分,得到117mL氢碘酸(密度为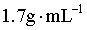 ,HI质量分数为57%)。
,HI质量分数为57%)。
回答下列问题:
(1)仪器A的名称:_______,通入H2S发生反应的化学方程式:_______。
(2)步骤ⅰ中快速搅拌的目的:_______(填序号)
a.便于产物分离 b.防止暴沸 c.防止固体产物包覆碘
(3)步骤ⅰ中随着反应的进行,促进碘溶解的原因_______(用离子方程式表示)。
(4)步骤ⅱ中的尾气常用_______(填化学式)溶液吸收。
(5)步骤ⅱ实验开始时的操作顺序:先通入N2,再加热;步骤ⅲ实验结束时相对应的操作顺序:_______。
(6)列出本实验产率的计算表达式:_______。
(7)氢碘酸见光易分解,易被空气氧化,应保存在_______。
【答案】(1) ①. 圆底烧瓶 ②. I2+H2S=S+2HI
(2)c (3)I2+I- I3-
I3-
(4)NaOH (5)先停止加热,再通一段时间的N2后关闭K2
(6)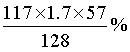
(7)密封的棕色细口瓶中,并放在避光低温处
【解析】
【分析】I2的氧化性比S强,A中发生I2+H2S=S↓+2HI,过滤除去S,得到含H2S的HI滤液;将滤液转移到B中,先通氮气、加热保持微沸除去H2S,升高温度,收集沸点为125℃~127℃间的馏分,得到117mL密度为1.7g/mL,质量分数为57%的HI溶液。
【小问1详解】
仪器A的名称为圆底烧瓶;I2的氧化性比S强,通入H2S发生反应的化学方程式为I2+H2S=S↓+2HI;
【小问2详解】
I2在水中的溶解度较小,生成的S可能包裹在其表面阻止反应的继续进行,故步骤ⅰ中快速搅拌的目的是防止固体产物包覆碘,选c;
【小问3详解】
I2和I-会发生反应:I2+I- I3-,步骤ⅰ中随着反应的进行,生成的HI电离出的I-与I2反应促进I2的溶解,本空答案为I2+I-
I3-,步骤ⅰ中随着反应的进行,生成的HI电离出的I-与I2反应促进I2的溶解,本空答案为I2+I- I3-;
I3-;
【小问4详解】
步骤ⅱ中的尾气为H2S,有毒,是酸性气体,常用NaOH溶液吸收;
【小问5详解】
为确保蒸馏装置内的HI全部进入C中,步骤ⅲ实验结束时相对应的操作顺序为:先停止加热,再通一段时间的N2后关闭K2;
【小问6详解】
127gI2的物质的量为0.5mol,n理论(HI)=2×0.5mol=1mol,m理论(HI)=1mol×128g/mol=128g、m实际(HI)=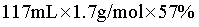 ,故HI的产率=
,故HI的产率= 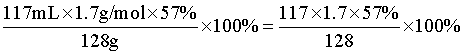 =
=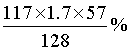 ;
;
【小问7详解】
氢碘酸见光易分解,易被空气氧化,应保存在密封的棕色细口瓶中,并放在避光低温处。
【2025河北等级考】16. 铬盐产品广泛应用于化工、医药、印染等领域。通过闭环生产工艺将铬铁矿转化为重铬酸钾同时回收利用钾资源,可实现绿色化学的目标。过程如下:
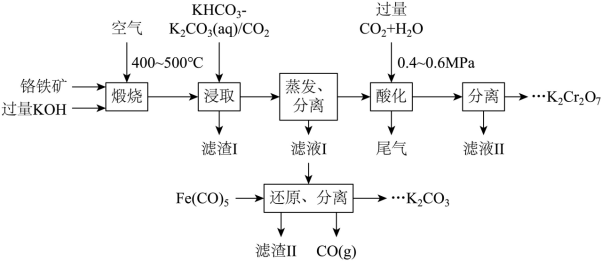
已知:铬铁矿主要成分是Fe(CrO2)2、Mg(CrO2)2、Al2O3、SiO2。
回答下列问题:
(1)基态铬原子的价层电子排布式:_______。
(2)煅烧工序中Fe(CrO2)2反应生成K2CrO4的化学方程式:_______。
(3)浸取工序中滤渣Ⅰ的主要成分:Fe2O3、H2SiO3、_______、_______(填化学式)。
(4)酸化工序中需加压的原因:_______。
(5)滤液Ⅱ的主要成分:_______(填化学式)。
(6)补全还原、分离工序中发生反应的化学方程式_______。
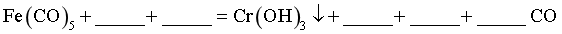
(7)滤渣Ⅱ可返回_______工序。(填工序名称)
【答案】(1)3d54s1
(2)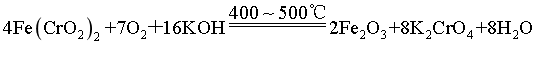
(3) ①. Al(OH)3 ②. MgO
(4)增大CO2的溶解度,保证酸化反应充分进行
(5)KHCO3
(6)Fe(CO)5+K2CrO4+4H2O=Cr(OH)3↓+Fe(OH)3↓+2KOH+5CO↑
(7)煅烧
【解析】
【分析】铬铁矿主要成分是Fe(CrO2)2、Mg(CrO2)2、Al2O3、SiO2,与过量KOH在空气中煅烧,生成K2CrO4、Fe2O3、MgO,KAlO2、K2SiO3;通入KHCO3 -K2CO3/CO2浸取,生成Al(OH)3、H2SiO3、Fe2O3、MgO不反应,故滤渣Ⅰ为:Al(OH)3、H2SiO3、Fe2O3、MgO,通过蒸发浓缩、冷却结晶、过滤分离出K2CrO4固体,滤液Ⅰ中含有K2CrO4;将K2CrO4中加水溶解,并通入过量CO2酸化,将K2CrO4转化为K2Cr2O7,同时副产物KHCO3 生成,将K2Cr2O7与KHCO3 分离,滤液Ⅱ的主要溶质为KHCO3 ;Fe(CO)5做还原剂,将滤液Ⅰ中剩余的K2CrO4还原为Cr(OH)3,自身转化为Fe(OH)3进入滤渣Ⅱ,KOH进一步处理得K2CO3,循环使用,据此分析;
【小问1详解】
Cr为24号元素,基态铬原子的价层电子排布式:3d54s1 ;
【小问2详解】
煅烧工序中Fe(CrO2)2与过量KOH、空气中氧气反应生成K2CrO4、Fe2O3、H2O,根据得失电子守恒,原子守恒,化学方程式: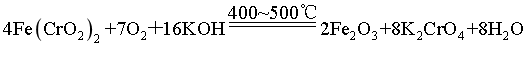 ;
;
【小问3详解】
根据分析可知,滤渣Ⅰ的主要成分:Al(OH)3、H2SiO3、Fe2O3、MgO;
【小问4详解】
向K2CrO4中加水溶解,并通入过量CO2酸化,将K2CrO4转化为K2Cr2O7,加大压强,可以增大CO2的溶解度,使液体中CO2浓度增大,保证酸化反应充分进行;
【小问5详解】
根据分析可知,滤液Ⅱ的主要溶质为KHCO3;
【小问6详解】
Fe(CO)5做还原剂,将滤液Ⅰ中剩余的K2CrO4还原为Cr(OH)3,自身转化为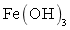 ,铁元素由0价升高到+3价,Cr由+6价降低到+3价,根据得失电子守恒,原子守恒,化学方程式:Fe(CO)5+K2CrO4+4H2O=Cr(OH)3↓+Fe(OH)3↓+2KOH+5CO↑ ;
,铁元素由0价升高到+3价,Cr由+6价降低到+3价,根据得失电子守恒,原子守恒,化学方程式:Fe(CO)5+K2CrO4+4H2O=Cr(OH)3↓+Fe(OH)3↓+2KOH+5CO↑ ;
【小问7详解】
滤渣Ⅱ含有Cr(OH)3和Fe(OH)3可返回煅烧工序。
【2025河北等级考】17. 乙二醇(EG)是一种重要的基础化工原料,可通过石油化工和煤化工等工业路线合成。
(1)石油化工路线中,环氧乙烷(EO)水合工艺是一种成熟的乙二醇生产方法,环氧乙烷和水反应生成乙二醇,伴随生成二乙二醇(DEG)的副反应。
主反应: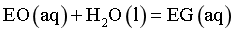
副反应: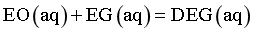
体系中环氧乙烷初始浓度为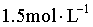 ,恒温下反应30min,环氧乙烷完全转化,产物中
,恒温下反应30min,环氧乙烷完全转化,产物中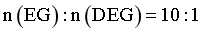 。
。
①0~30min内,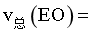 _______
_______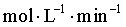
②下列说法正确的是_______(填序号)。
a.主反应中,生成物总能量高于反应物总能量
b.0~30min内,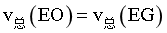
c.0~30min内,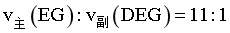
d.选择适当催化剂可提高乙二醇的最终产率
(2)煤化工路线中,利用合成气直接合成乙二醇,原子利用率可达100%,具有广阔的发展前景。反应如下:2CO(g)+3H2(g) HOCH2CH2OH(g)ΔH。按化学计量比进料,固定平衡转化率α,探究温度与压强的关系。α分别为0.4、0.5和0.6时,温度与压强的关系如图:
HOCH2CH2OH(g)ΔH。按化学计量比进料,固定平衡转化率α,探究温度与压强的关系。α分别为0.4、0.5和0.6时,温度与压强的关系如图:
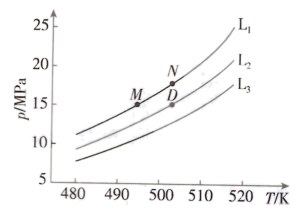
①代表α=0.6的曲线为_______(填“L1”“L2”或“L3”);原因是_______。
②ΔH_______0(填“>”“<”或“=”)。
③已知:反应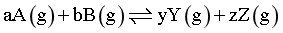 ,
,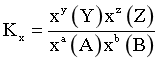 ,x为组分的物质的量分数。M、N两点对应的体系,
,x为组分的物质的量分数。M、N两点对应的体系,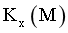 _______
_______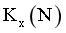 (填“>”“<”或“=”),D点对应体系的
(填“>”“<”或“=”),D点对应体系的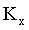 的值为_______。
的值为_______。
④已知:反应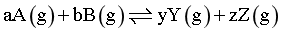 ,
,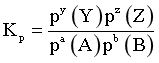 ,p为组分的分压。调整进料比为
,p为组分的分压。调整进料比为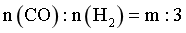 ,系统压强维持
,系统压强维持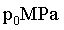 ,使
,使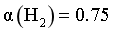 ,此时
,此时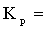 _______
_______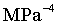 (用含有m和P0的代数式表示)。
(用含有m和P0的代数式表示)。
【答案】(1) ①. 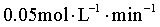 ②. cd
②. cd
(2) ①. L1 ②. 该反应为气体体积减小的反应,温度相同时,增大压强,平衡正向移动,平衡转化率增大 ③. < ④. = ⑤. 12 ⑥. 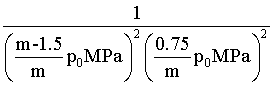
【解析】
【小问1详解】
①0~30min内,环氧乙烷完全转化,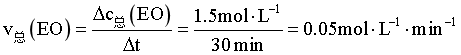 ;
;
②a. ,主反应中,ΔH<0,则生成物总能量低于反应物总能量,a错误;
,主反应中,ΔH<0,则生成物总能量低于反应物总能量,a错误;
b.由题中信息可知主反应伴随副反应发生,EG作为主反应的生成物同时也是副反应的反应物,即EG浓度的变化量小于EO浓度的变化量,0~30min内,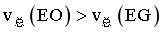 ,b错误;
,b错误;
c.主反应中,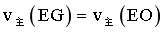 ,副反应
,副反应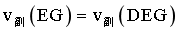 ,同一反应体系中物质一量变化量之比等于浓度变化量之比,产物中
,同一反应体系中物质一量变化量之比等于浓度变化量之比,产物中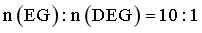 ,即
,即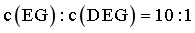 ,
,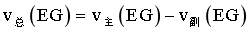 ,反应时间相同,则
,反应时间相同,则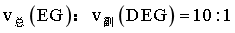 ,
,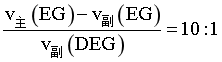 ,则
,则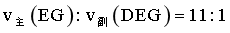 ,c正确;
,c正确;
d.选择适当催化剂可提高主反应的选择性,可提高 乙二醇的最终产率,d正确;
故选cd;
【小问2详解】
①2CO(g)+3H2(g) HOCH2CH2OH(g)ΔH该反应为气体体积减小的反应,温度相同时,增大压强,平衡正向移动,平衡转化率增大,
HOCH2CH2OH(g)ΔH该反应为气体体积减小的反应,温度相同时,增大压强,平衡正向移动,平衡转化率增大,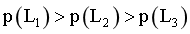 ,故L1、L2、L3对应α为0.6、0.5、0.4;
,故L1、L2、L3对应α为0.6、0.5、0.4;
②由图可知,压强相同时,温度升高,平衡转化率减小,说明升高温度平衡逆向移动,则正反应为放热反应,ΔH<0;
③M、N的进料相同,平衡转化率相等,平衡时各组分物质的量分数分别相等,则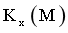 =
=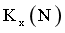 ;D点对应的平衡转化率为0.5,根据题中信息,该反应按化学计量比进料,设起始加入2molCO和3molH2,列三段式:
;D点对应的平衡转化率为0.5,根据题中信息,该反应按化学计量比进料,设起始加入2molCO和3molH2,列三段式: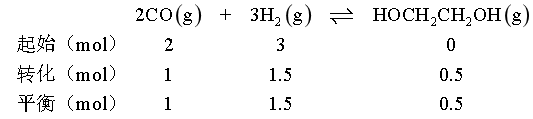 ,平衡时,CO、H2、HOCH2CH2OH的物质的量分数分别为
,平衡时,CO、H2、HOCH2CH2OH的物质的量分数分别为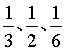 ,
,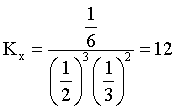 ;
;
④设起始加入mmolCO和3molH2,此时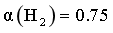 ,列三段式:
,列三段式: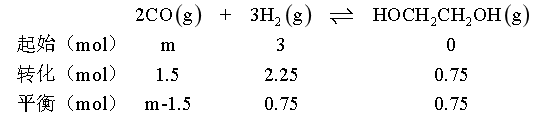 ,平衡时,气体总的物质的量为mmol,CO、H2、HOCH2CH2OH平衡分压分别
,平衡时,气体总的物质的量为mmol,CO、H2、HOCH2CH2OH平衡分压分别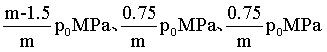 ,
,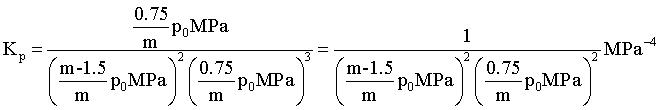 。
。
【2025河北等级考】18. 依拉雷诺(Q)是一种用于治疗非酒精性脂肪性肝炎的药物,其“一锅法”合成路线如下:
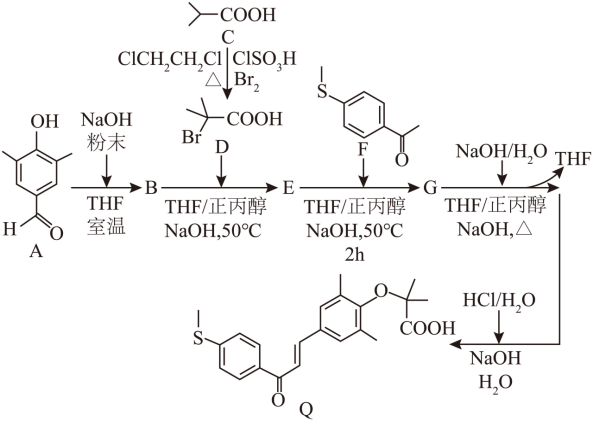
回答下列问题:
(1)Q中含氧官能团的名称:_______、_______、_______。
(2)A→B的反应类型:_______。
(3)C的名称:_______。
(4)C→D反应中,在加热条件下滴加溴时,滴液漏斗末端位于液面以下的目的:_______。
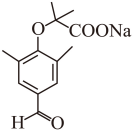
(5)“一锅法”合成中,在NaOH作用下,B与D反应生成中间体E,该中间体的结构简式:_______。
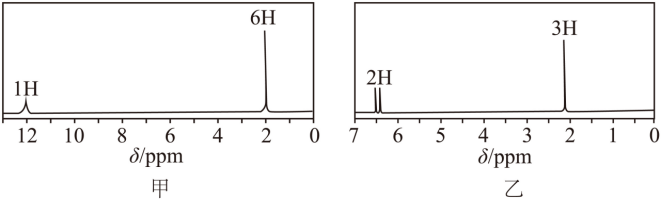
(6)合成过程中,D也可与NaOH发生副反应生成M,图甲、图乙分别为D和M的核磁共振氢谱,推断M的结构,写出该反应的化学方程式:_______。
(7)写出满足下列条件A的芳香族同分异构体的结构简式:_______。
(a)不与FeCl3溶液发生显色反应;
(b)红外光谱表明分子中不含C=O键;
(c)核磁共振氢谱有三组峰,峰面积比为1:1:3;
(d)芳香环的一取代物有两种。
【答案】(1) ①. 羰基 ②. 醚键 ③. 羧基 (2)取代反应
(3)异丁酸或2-甲基丙酸
(4)溴易挥发,减少损失,提高利用率
(5) (6)
(6)

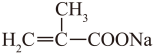
(7)
【解析】
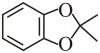
【分析】A含酚羟基,和氢氧化钠反应生成B为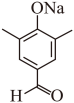 ,羧基和氢氧化钠能发生中和反应,B含羧基和碳溴键,则B与D反应生成溴化钠和E,E为
,羧基和氢氧化钠能发生中和反应,B含羧基和碳溴键,则B与D反应生成溴化钠和E,E为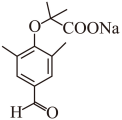 ,E和F发生羟醛缩合反应生成G为
,E和F发生羟醛缩合反应生成G为 ,-COONa经酸化可转化为羧基,则G在氢氧化钠、加热下脱氢溶剂THF、再酸化转化为Q;
,-COONa经酸化可转化为羧基,则G在氢氧化钠、加热下脱氢溶剂THF、再酸化转化为Q;
【小问1详解】
据分析,Q中含氧官能团的名称为羰基、醚键和羧基;
【小问2详解】
A→B的反应中,酚羟基转化为-ONa,则反应类型为取代反应;
【小问3详解】
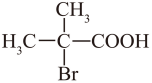
根据C的结构简式,C的名称为<>异丁酸或2-甲基丙酸;
【小问4详解】
C与溴单质发生取代反应生成D,溴易挥发,则C→D反应中,在加热条件下滴加溴时,滴液漏斗末端位于液面以下的目的:减少溴的挥发损失,提高利用率;
【小问5详解】
B与D反应生成E,一方面是羧基和氢氧化钠发生了中和、-COOH转化为-COONa,另一方面,酚钠(ONa)和碳溴键发生了取代反应,则E为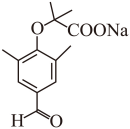 ;
;
【小问6详解】
D也可与NaOH发生副反应生成M,D分子内有2种氢,1个是羧基上的氢原子,另一种为2个甲基上的6个氢原子,则甲为D,乙为M,据图,M分子内有2种氢,数目分别有2个、3个,则M为碳溴键在氢氧化钠醇溶液中发生消去、羧基发生中和生成,M为 ,则该反应的化学方程式:
,则该反应的化学方程式:

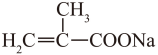 。
。
【小问7详解】
A的芳香族同分异构体满足下列条件:
(a)不与FeCl3溶液发生显色反应,则不含酚羟基;
(b)红外光谱表明分子中不含C=O键,
(c)核磁共振氢谱有三组峰,峰面积比为1:1:3,则分子内有3种氢原子,由于A分子式为C9H10O2,则A中这2种氢原子的数目为2、2、6个;
(d)芳香环的一取代物有两种,则苯环上有2种氢;
结合分子内有5个不饱和度,可知满足条件的同分异构体为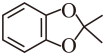 。
。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。一、选择题:本大题共 16 小题,共 44 分。第 1- 题,每小题 2 分;第 11-16 小题,每...
一、选择题:本题共 7 小题,每小题 6 分,共 42 分。在每小题给出的 4 个选项中,只...
一、选择题 ( 本大题共 16 小题,每小题 3 分,共 48 分。每小题列出的四个备选项中只...
1. 定窑是宋代五大名窑之一,其生产的白瓷闻名于世。下列说法正确的是 A. 传统陶瓷是...
可能用到的相对原子质量: H-1 C-12 N-14O-16 Mg-24 S-32 第一部分 本部分共 14 小题...
一位资深的班主任曾说:“家长与学校配合得越好,教育越会成功。我可以非常负责任的说...