
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
有机化合物种类繁多的一个重要因素,就是同分异构现象非常普遍。有机化合物的同分异构可分为两大类,即构造异构和立体异构。构造异构是分子式相同,分子中原子相互连接的顺序和方式不同,所产生的异构,它包括四种类型,即碳链异构(如正丁烷和异丁烷)、官能团位置异构(如1—丁烯和2—丁烯),官能团异构(如丁醇和乙醚)和互变异构。立体异构是指分子的构造相同,分子中原子或基团在空间的排列方式不同而起的异构。它包括几何异构(顺反异构)、光学异构和构象异构。光学异构是物质对偏振光的作用不同所产生的异构,构象异构是由于碳碳单键自由旋转而导致的所连原子或基团在空间的不同排列方式所形成的异构现象。
11.1 光学异构
又称为手性异构,任何一个不能和它的镜像完全重叠的分子就叫做手性分子,它的一个物理性质就是能使偏振光的方向发生偏转,具有旋光活性。
构造相同的分子,如使其一平面偏振光向右偏转,另一侧向左。则两种互为光学异构体。(所谓光学异构体指分子结构完全相同,物理化学性质相近,但旋光性不同的物质)
11.1.1 物质的光学活性
1.偏振光
光是一种电磁波,它的振动方向与前进方向相互垂直,普通光的光波在垂直于它前进方向所有可能的平面上振动。图11-1表示普通光的振动情况,原点O表示垂直于纸面的光的前进方向,双箭头代表光可能的振动的平面。如果将普通光通过一个由方解石片制成的尼克尔(Nicol)棱镜,如图11-2所示。
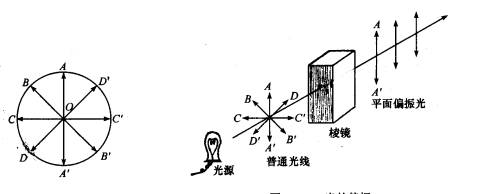
图11-1 普通光的振动 图11-2 偏振光的振动
尼克尔棱镜像栅栏一样,只允许与棱镜镜轴平行的平面上振动的光线AA通过,而在其它平面上振动的光线BB、 CC、 DD 等均被阻档。像这种透过尼尔棱镜只在一个平面上振动的光称为偏振光。
2.物质的旋光性
实验发现,当偏振光透过一些天然物质的水溶液时会产生两种现象;一种是像水、酒精等物质,不使偏振光的振动平面发生旋转,此类物质称为非旋光物质或非光学活性物质。另一种是像乳酸、酒石酸等物质,可以使偏振光的振动平面旋转一定角度,这类物质称为旋光物质或光学活性物质。旋光物质中能使偏振光向右旋转的称为右旋体,用(+)号表示;能使偏振光向左旋转的称为左旋体,用(-)号表示。如从肌肉中提取的乳酸就是(+)乳酸,而由葡萄糖酵得到的乳酸则是(-)乳酸。等量的左旋体和右旋体组成的混合体系,失去旋光性、称为外消旋体,用(±)表示。如酸牛奶中的乳酸就是(±)乳酸,外消旋体没有光学活性,但可以拆分为左旋和右旋两个具有旋光活性的异构体。
3.旋光度和比旋光度
旋光物质的旋光方向和旋光角度可用旋光仪进行测定,图11-3是旋光仪的工作原理。光源发出的光通过起偏镜、产生偏振光,偏振光通过盛液管,如果盛液管装的是乳酸等旋光物质,则会使偏振光的振动平面发生转动,检偏镜需要向左或向右旋转一定角度才能看到光透过。如果盛液管中装的是水等非旋光物质,检偏镜不需要旋转,只需与起偏镜保持平行,就可以看到光透过。
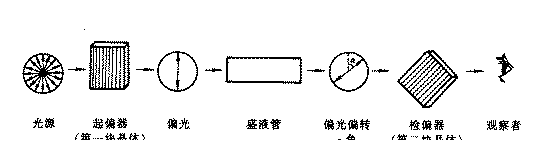
图11-3 旋光仪的工作原理
旋光物质使偏振光旋转的角度称为旋光度,一般用![]() 表示,
表示,![]() 与溶液的浓度、盛液管的长度,测定时的温度以及光源和溶剂的性质有关。为了消除溶液浓度和盛液管长度对旋光度
与溶液的浓度、盛液管的长度,测定时的温度以及光源和溶剂的性质有关。为了消除溶液浓度和盛液管长度对旋光度![]() 的影响,引入比旋光度的概念,比旋光度用
的影响,引入比旋光度的概念,比旋光度用![]() 表示,比旋光度
表示,比旋光度![]() 与旋光度
与旋光度![]() 的关系为:
的关系为:
![]()
![]() =
=![]()
式中:t为测定时的温度,单位℃;![]() 为旋光仪所用光源的波长(通常用钠光做光源,波长为589nm,用D表示);
为旋光仪所用光源的波长(通常用钠光做光源,波长为589nm,用D表示);![]() 为旋光物质的浓度,单位是g.ml-1,如果是纯液体,
为旋光物质的浓度,单位是g.ml-1,如果是纯液体,![]() 则改为密度
则改为密度![]() ,单位g.cm-3;l为盛液管的长度,单位是dm。比旋光度
,单位g.cm-3;l为盛液管的长度,单位是dm。比旋光度![]() 是旋光物质在光源波长和测定温度一定的条件下,溶液浓度为1g.ml-1,盛液管长度为1dm时的旋光度.如20℃时,用钠光源的旋光仪测定葡萄糖和果糖水溶液的比旋光度,分别为右旋53º和左旋93º写作
是旋光物质在光源波长和测定温度一定的条件下,溶液浓度为1g.ml-1,盛液管长度为1dm时的旋光度.如20℃时,用钠光源的旋光仪测定葡萄糖和果糖水溶液的比旋光度,分别为右旋53º和左旋93º写作![]() =+53º(水) 和
=+53º(水) 和![]() =-93º(水)。与物质的熔点、沸点、密度等一样,比旋光度也是一个物理常数,可以定量地描述光学活性物质的一个特性——旋光性。
=-93º(水)。与物质的熔点、沸点、密度等一样,比旋光度也是一个物理常数,可以定量地描述光学活性物质的一个特性——旋光性。
11.1.2 含有一个手性碳原子的化合物
1.手性与手性分子
人的左右手,似乎没有什么区别,但两只手的五根手指的排列顺序是相反的,因此两只手不能完全重合。把右手放在镜子前,镜子中的镜像恰恰是左手;同样道理,把左手放在镜子前,镜子中的镜像恰恰是右手,左手和右手互呈实物与镜像关系。像左右手这样互呈实物与镜像关系而不能完全重合的特性称为手征性,简称手性。手性不仅是某些宏观物质的特性,有些微观分子也具有手性,这样的分子称为手性分子。凡具有手性的分子都具有旋光性质。分子的手性产生于分子的内部结构,与分子的对称性有关。判断一个分子是否具有手性,一般只需考虑其是否具有对称因素,即对称中心和对称面。对于大多数有机分子,尤其是链状化合物一般只考虑是否具有对称面。如果一个分子的所有原子都在同一平面上,如乙烯、苯等;或有一个穿过该分子并能把它分成实物与镜像两部分的平面,这个平面就是对称面。图11-4是二氯甲烷立体结构,它存在着两个对称平面,因此,没有手性,也没有旋光性。
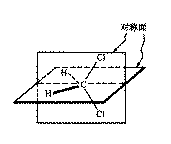
图11-4 二氯甲烷
2.含有一个手性碳原子的化合物
乳酸 ![]() 具有旋光性,其显著特点是
具有旋光性,其显著特点是![]() -碳原子所连的四个基团-CH3,-OH,-H和-COOH不相同,这样的碳原子称为手性碳原子,简称手性碳,一般用※号标记。分子具有手性的最普通因素是具有手性碳。下列分子都是含有一个手性碳的手性分子:
-碳原子所连的四个基团-CH3,-OH,-H和-COOH不相同,这样的碳原子称为手性碳原子,简称手性碳,一般用※号标记。分子具有手性的最普通因素是具有手性碳。下列分子都是含有一个手性碳的手性分子:
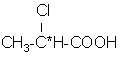
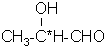
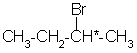
它们都像乳酸一样具有旋光性,存在左旋体和右旋体。
3.手性分子构型表示方法
分子是立体的,而纸面是平面的,要在平面的纸上表示立体的分子构型,一般常用透视式和投影式。
(1)透视式 透视式是将手性碳和另外两个基团放在纸面上,并用实线连接,用楔型实线表示伸出纸面前的基团,用虚线表示伸向纸面后的基团,这样乳酸 ![]() 的两种旋光异构体可表示如下:
的两种旋光异构体可表示如下:
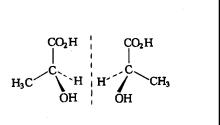
(-)-乳酸 (+)-乳酸
乳酸的左旋体和右旋体互呈实物与镜像的关系,它们的结构式相同,只是手性碳所连的四个基团排列顺序不同,因此不能完全重合,这种异构称为对映异构体,它们使偏振光的旋转角度相同,但方向相反,(+)乳酸的![]()
![]() =+3.28º(水),(-)-乳酸的
=+3.28º(水),(-)-乳酸的![]()
![]() =-3.28º(水)。用透视法表示手性分子的构型清晰直观,但书写麻烦,对于结构复杂的分子,增加了书写的难度。
=-3.28º(水)。用透视法表示手性分子的构型清晰直观,但书写麻烦,对于结构复杂的分子,增加了书写的难度。
(2)费歇尔(E.Fischer)投影式。 费歇尔投影式是采用投影的方法把手性分子的构型表示在纸面上。用十线的交叉点代表手性碳原子,水平线所连的两个原子或基团伸出纸面外,竖直线所有的两个原子或基团伸向纸面里。投影时将含手性碳的碳键竖直摆放,把命名时编号最小的碳原子放在上端,这样乳酸的两种对映异构体可表示为
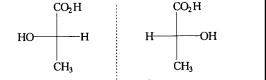
(+)-乳酸 (-)-乳酸
使用费歇尔投影式时,要注意投影式不能离开纸面翻转,也不能旋转90º或270º,因为这样会改变手性碳原子的构型;但可以在纸面上旋转180º,不改变分子的构型关系,仍代表原来分子的构型。如果固定手性碳原子的一个基团位置,而把另外三个基团顺时针或逆时针调换位置,不改变原化合物的构型;如果将手性碳原子所连的任何两个基团交换位置,会使构型变为它的对映异构体,连续交换两次不改变原分子的构型。
(3)R、S标记法
为了表示旋光异构体的不同构型,需要对手性分子进行标记。顺反异构体可以用“顺”、“反”或(Z)、(E)来标记异构体。旋光异构体一般采用R、S标记。
具体方法是:先将与手性碳所连的四个基团按次序规则排定顺序,对于乳酸来说,四个基团的顺序为:-OH> -COOH > -CH3 >-H ,然后将四个基团中最小的(-H),放在离眼睛最远的位置 ,观察剩余三个基团从大到小的排列顺序,即由-OH经-COOH到-CH3的走向,如为顺时针方向,用R表示;如为逆时针方向,以S表示。
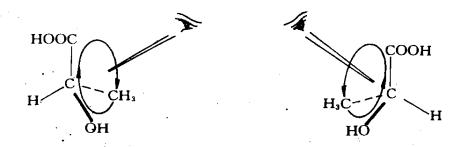
顺时针位R-型 逆时针位S-型
使用透视是比较容易确定对映异构体的构型,但在熟悉了这种方法之后,即使使用费歇尔投影式,也不难确定分子构型,如乳酸的一对对映异构体可表记为:
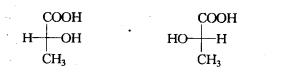
(R)-乳酸 (S)-乳酸
需要说明的是,R、S只是表示光学异构体的不同构型,和旋光方向无必然联系。
(4)D、L标示法
在1951年前还没有实验方法测定分子的构型,因而选择一个简单的对映体,人为规定它的构型。费歇尔选择了(+)-甘油醛作为标准,其投影式为三个碳原子在竖线上,-CHO位于上方,-CH2OH位于下方,(+)-甘油醛的羟基在右边,定为D构型(拉丁文意思为右),其对映体(-)-甘油醛的羟基在左边,定为L构型(拉丁文意思为左)
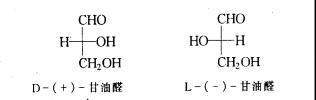
然后将其它分子的对映体构型与标准甘油醛通过各种直接或间接的方式相联系,来确定其构型。D、L标示法有一定的局限性,它一般只能标示含一个手性碳原子的构型,而有些化合物,特别是含多个手性碳原子的化合物,用相联系的方法难以实现。由于长期习惯,糖类和氨基酸类化合物,目前仍沿用D、L构型标示方法。
D、L构型的标示方法,是早期人们无法实际测出旋光物质的绝对构型,而人为规定的构型标示方法。因为它基于相对于人为规定的甘油醛的构型作为标准,因此D、L构型又称相对构型,它与R、S构型之间没有必然的对应关系。
11.1.3 不含手性碳原子的旋光异构体
含有手性碳原子是使分子产生手性的因素之一,但具有手性的分子不一定含有手性碳原子。如联苯分子中每个苯环邻位上的氢原子被体积较大的不同基团-COOH和-NO2取代,由于位置阻碍作用使两个苯环不能处在同一平面内,同时连接两个苯环的碳碳单键的自由旋转也受到了取代基的阻碍,整个分子由于没有对称因素而具有手性,存在一对对映异构体。再如反-1,2-环丙烷二甲酸,分子中没有对称面和对称中心,是手性分子,有对映异构体。
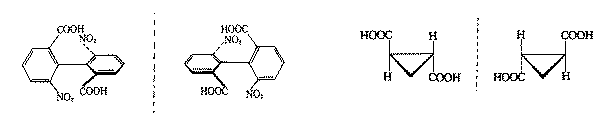
除了含碳的手性分子外,含其它元素原子的化合物也可能具有手性,与碳同族的Si、Ge原子如连有四个不同基团时也可能成为手性分子。季铵盐具有四面体构型也可能有旋光异构体存在。
11.2 构象异构
在有机化学的发展史中,对分子结构的认识经历了一个较长的历史过程,最初认为单键可以自由旋转,不受任何阻碍。随着实验和理论研究的逐步深入,到了上个世纪30年代才认识到即便象乙烷(CH3- CH3)这样简单的分子,碳碳单键的旋转也不是自由的,需要克服一定的能垒(约12.6KJ.mol-1)才能转动,于是提出了构象的概念。
11.2.1 乙烷的构象
1.构象的概念
乙烷是最简单的C-C单键化合物。在乙烷分子中,如果固定一个甲基,使另一个甲基绕C-C单键转动,两个甲基上的氢原子的相对位置就会不断地变化,形成不同的空间排列方式。这种由于绕单键旋转而产生的分子中原子或基团在空间的不同排列方式叫做构象。C-C单键的旋转角度可以无穷小,排列方式也就无穷多,也就是说乙烷分子的构象有无穷多个。
2.构象的表示方法
表示构象一般用透视式和投影式两种方法,透视式又称锯架式,透视式是从侧面观察分子、夸大键的长度,把所有原子和键都能画出来,但比较难画。投影式又称纽曼式,是在C-C键的延长线上观察分子,用三线交点表示距眼睛近的碳原子,用圆圈表示距眼睛远的碳原子,每个碳原子上的三个C-H 键互成120°角,乙烷的构象可用两种方法表示,如图11-5
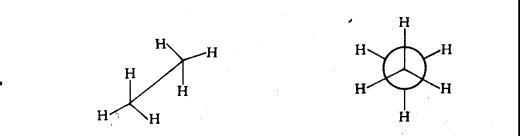
(a)-透视式 (b)-投影式
图11-5构象的表示方法
3.乙烷的典型构象
乙烷分子的构象有无穷多个,在众多构象中,两个甲基相互重叠,两个碳原子上氢原子彼此距离最近的构象,叫作重叠式。从重叠式开始,保持一个甲基不动,另一个甲基绕C-C单键旋转,当转动60°角时,两个甲基正好交叉,两个碳原子上的氢原子彼此距离最远,这种构象叫做交叉式,重叠式和交叉式是乙烷的典型构象。继续使这个甲基绕C-C单键转动至120°、240°、360°时的构象为重叠式;转动至180°、300°时的构象为交叉式。图11-6 是乙烷分子典型构象和能量变化曲线。
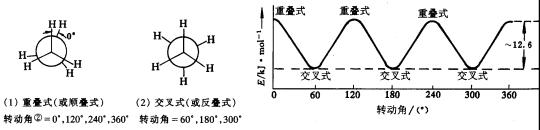
图11-6 乙烷的构象和能量变化
不同构象,分子的能量是不同的,其稳定性当然也不同。在乙烷的无数构象中,能量最低,稳定性最高的是交叉式;能量最高,稳定性最差的是重叠式。两者之间的能量差为12.6KJ·mol-1,其它的构象的能量介于这两者之间。图11-6是乙烷不同构象间的能量变化曲线。从图11-6可以看出,乙烷从交叉式旋转到重叠式必须克服12.6KJ·mol-1的能量,这个能量来自两个碳原子的C-H键的![]() 电子对的相互斥力。交叉式中,乙烷分子中两个碳原子上的C-H键距离最远,
电子对的相互斥力。交叉式中,乙烷分子中两个碳原子上的C-H键距离最远,![]() 电子对之间斥力最小,所以能量最低。从交叉式开始,一个甲基保持不动,另一个甲基绕C-C单键旋转,两个碳原子上C-H键距离越来越近,
电子对之间斥力最小,所以能量最低。从交叉式开始,一个甲基保持不动,另一个甲基绕C-C单键旋转,两个碳原子上C-H键距离越来越近,![]() 电子对之间的斥力也越来越大,分子的能量也越来越高。达到重叠式时,两个碳原子上的C-H键距离最近,
电子对之间的斥力也越来越大,分子的能量也越来越高。达到重叠式时,两个碳原子上的C-H键距离最近,![]() 电子对之间斥力最大,分子的能量也最高。
电子对之间斥力最大,分子的能量也最高。
分子处于热运动状态时,相互碰撞,发生能量交换,如果分子取得的能量超过两交叉式之间的能垒,就可以绕C-C单键旋转,由一种交叉式构象转变成另一种交叉式构象。室温下,分子具有的能量足以使分子处于高速转变之中,温度越高,这种转变越快,分子处于无数构象的动态平衡之中。但大部分时间分子处于能量最低的交叉式构象,这种构象称为优势构象。构象异构与光学异构不同,常温下分离不出来构象异构体。
11.2.2 丁烷的构象
1.丁烷的典型构象
丁烷的构象比乙烷复杂得多,为简便起见,把丁烷看成是乙烷的二甲基衍生物,固定C1、C2不动,讨论C4沿C2-C3单键旋转所形成的构象,在无数构象中,有图11-7所示的四种典型构象:
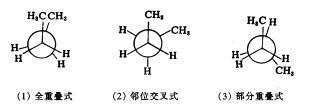
图11-7 丁烷的典型构象
以全重叠式为始点,旋转60°、300°是邻位交叉式,旋转120°、240°是部分重叠式,旋转180°是对位交叉式,旋转360°是全重叠式。
2.丁烷构象的能量变化
几种典型构象的分子能量高低为:全重叠式>部分重叠式>邻位交叉式>对位交叉式。其能量变化如图11-8 ,丁烷的优势构象为对位交叉式。
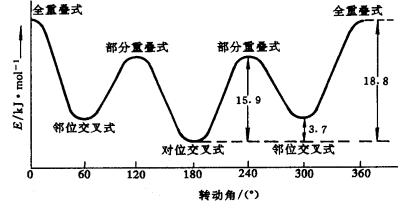
图11-9 丁烷构象和能量变化曲线
丁烷构象的能量变化是由于C2、C3原子上的甲基和氢原子的相对位置产生的,在对位交叉式中,![]() 键电子对之间的斥力最小,C2和C3原子上的甲基与甲基距离最远,非键斥力(范德华排斥力)也最小,能量最低,是优势构象。其次是邻位交叉式构象,能量较低。再次是部分重叠式构象,能量较高。能量最高是全重疊式,
键电子对之间的斥力最小,C2和C3原子上的甲基与甲基距离最远,非键斥力(范德华排斥力)也最小,能量最低,是优势构象。其次是邻位交叉式构象,能量较低。再次是部分重叠式构象,能量较高。能量最高是全重疊式,![]() 键电子对之间斥力最大,C2、C3原字上的两个甲基距离最近,非键张力也最大。这些构象之间的能量差不太大,在室温下可以通过C2-C3键旋转相互转化,达到动态平衡,优势构象的对位交叉式约占72.%,邻位交叉式约占28%,部分重叠和全重叠式极少。
键电子对之间斥力最大,C2、C3原字上的两个甲基距离最近,非键张力也最大。这些构象之间的能量差不太大,在室温下可以通过C2-C3键旋转相互转化,达到动态平衡,优势构象的对位交叉式约占72.%,邻位交叉式约占28%,部分重叠和全重叠式极少。
丁烷分子也可以绕C1-C2 或C3-C4键旋转而产生不同的构象。
11.2.3 环己烷的构象
1.椅式与船式构象
在环己烷中,六个碳原子均为SP3杂化,碳原子之间保持109.5°的键角。由于C-C单键的转动,环乙烷也有无数种构象,其中有两种典型构象如图11-9所示,值得研究。一种是C1、C2 、C4 、C5四个碳原子在同平面内,C3 和C6 两个原子分别在平面的上面和下面,其形状就象一把椅子,C3 像椅背,C6像椅腿,这种构象称为椅式构象。另一种是C1、C2 、C4、C5 四个原子在同一平面内,C3和C6 两个原子都在平面上面,形状像船,C3和C6 两原子分别是船头和船尾,这种构象称为船式,环己烷的构象用透视法表示。
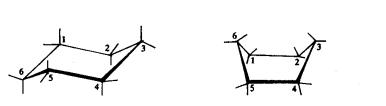
(1)椅式 (2)船式
图11-9 环己烷的两种典型构象
环己烷的椅式构象中,任何两个相邻的C-H键和C-C键都是邻位交叉的,非键合的两个氢原子的最近距离的0.25nm,它既无角张力,也无扭转张力,是无张力环。在船式构象中C1、C2 、C4 、C5 原子上的C-C和C-H键都处于全重叠构象,船头和船尾的C3和C6 两原子各有一个C-H键,伸向船内,两氢原子间的距离为0.183nm,小于正常的非键合距离(0.24nm),互相排斥,船式构象既有扭转张力又有非键张力,它的能量比椅式高,不稳定。如图11-10
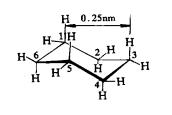
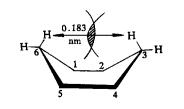
图11-10 环己烷的椅式和船式结构
室温下,在环己烷构象的平衡体系中,椅式构象约占99.9%,船式约为0.1%,椅式构象为环已烷的优势构象。
2.直立键和平伏键
在环已烷的椅式构象中,C1、C3 、C5 在同一平面上;C2、C4 、C6 在另一平面上,两平面相互平行,电子衍射实验证实这两个平面的距离0.05nm。在椅式构象中可以把12个C-H键分成两类,一类是垂直于C1、C3 、C5 平面和C2、C4 、C6 平面的6 个C-H键,称为直立键,或a键;另一类是与C1、C3 、C5 平面和C2、C4 、C6 平面近似平行的6个C-H键,称为平伏键,或e键。
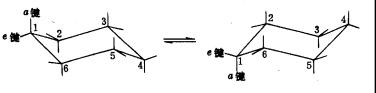
图11-11 环已烷a键和e键的转变
环已烷分子在不停地做热运动,它可以由一种椅式构象翻转成另一种椅式构象,在翻转过程中,原来的a键就变成e键,原来的e键则变成了a键。
3.一取代环已烷的构象
在椅式环已烷构象中,每个碳原子各有一个a键和一个e键,C1、C3 、C5 上的3上a键在同一侧;C2、C4 、C6 上的3个a键在另一侧,同侧a键上的氢原子距离很近,是0.25nm。6个e键中,相邻两个碳原子的e键上的氢原子相距却很远。当环已烷分子中的一个氢原子被其它原子或基团如甲基取代时,取代基可以以a键,也可以以e键与环相连,这就产生两种不同构象异构体,即a型和e型,如图11-12所示。
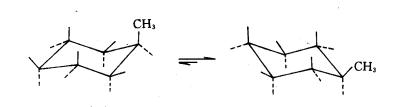
(1)-a型 (2)-e型
图11-12 甲基环己烷的两种构型
在一取代环已烷中,取代基在e键上比在a键上稳定,一般以e键的构象为主。因为取代基在e键的构象,取代基伸向环外,与相邻碳原子上的氢原子距离较远,排斥作用很小。而取代基在a键上的构象,取代基与同侧a键的氢原子距离很近,有较大的排斥作用,甲基环已烷主要以e型构象为主。取代基越大,在e键上的构象的比率越大,甲基环已烷,在e键上的构象占95%,在a键上的构象占5%;异丙基环己烷构象中,异丙基在e键上的构象占97%,在a键上的构象占3%。因此,在一取代环已烷中e型构象是优势构象。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
【导读】淀粉和纤维素的核心结构单元都是葡萄糖CHO,都是由葡...
皂化值 皂化值即1g油脂完全皂化所需氢氧化钾的毫克数。此值反...
一、概念 等电点(pI,isoelectric point) 例如:在某一pH的溶液中,氨...
支链淀粉和直链淀粉的不同 糯性品系的米粒中含有支链淀粉,用...
果糖是酮糖,没有醛基,按理应无还原性,但与葡萄糖一样却能...
如果把碳的几种单质视为一种孪生现象,那么在碳的化合物中,...