
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
酯化反应是中学阶段有机化学中非常重要的一类反应是教学的重点、难点,也是历年高中化学命题的热点和落脚点。以“酯化反应”为切入点是命题和解题的主要思想。
一、正确理解酯化反应的定义
人教版《必修2》中酯化反应的定义是:酸和醇反应生成酯和水的反应。
例1:下列属于酯化反应的是( )
A.cH3CHZOH+HBr→CH3CH2Br+H2O
B.CH3CH3OH+HNO3→CH3CH2ONO2+H2O
C.C6H5CH2Cl+C6H5COONa→C6H5COOCH2C6H5+NaCl
D.nHO-CH2-CH2OH+nHOOC一COOH→H O一CH2-OCO-CO
O一CH2-OCO-CO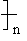 OH+(2n一1)H2O
OH+(2n一1)H2O
解析:醇与酸之间的反应,不一定是酯化反应,A错。生成酯的反应,不一定是酯化反应,C错。含氧酸和醇反应生成聚酯和水,为缩聚反应,D错。答案为B。
点拨:高中阶段对酯化反应正确的理解为:含氧酸和醇轻基反应生成小分子酯和水的反应。
二、正确理解酯化反应的机理
同位素示踪法是研究有机化合物合成机理常用方法。人教版《选修5》中利用同位素示踪法证实酯化反应的机理为“酸脱羟基,醇脱羟基氢原子”。
例2:为了探究酯化反应中的脱水方式,一般采取同位素示踪法,用18O同位素进行标记时,18O只能标记在_ (填“醇羟基”、“羧酸的羟基”或“羧酸的羰基上)。用18O标记的乙酸与乙醇反应制取乙酸乙酯,当反应达到平衡时,下列说法正确的是( )
A.18O只存在于乙酸乙酯中
B.18O存在于水、乙酸、乙醇以及乙酸乙酯中
C.18O存在于乙酸乙酯、乙醇中
D.若此乙醇与丙酸反应生成的酯的相对分子质量为102
解析:同位素示踪法探究酯化反应机理时,18O只能标记在醇轻基上。最终18O存在于体系乙酸乙酯、乙醇中。答案为C。
点拨:利用“酸脱羟基,醇脱羟基氢原子”原理,进行有机推断和合成,进而书写二元醇与二元竣酸、羟基羧酸(如乳酸)酯化成环酯的方程式是考试命题的热点。
注意:羧酸与某些叔醇、含氧无机酸与醇酯化反应时,是“醇脱羟基,酸脱羧基氢”,要求提醒学生注意审题,避免定势思维造成错误。
三、深入理解酯化反应中的“守恒”
从“量的变化看:酯化反应时,1个一OH与1个一COOH反应生成1个一COO一和1个H2O。
若醇分子中一OH和羧酸分子中一COOH完全酯化时,存在以下关系:
质量守恒:m(酸)+m(醇)=m(酯)+m(H2O)
碳原子数:n(醇)+n(羧酸)=n(酯)
氢原子数:n(醇)+n(羧酸)=n(酯)+n(水)
氧原子数:n(醇)+n(羧酸)=n(酯)+n(水)
例3:把9.0g乙二酸和某二元醇混合,在一定条件下完全酯化,生成Wg环酯和36g水,则该醇的相对分子质量可以表示为( )
A.10W一54
C.45(W一36)
B.5W+135
D.2W+10.8
解析:利用质量守恒推出醇的质量为W一54克,再计算出醇的物质的量为0.1mol,则醇的相对分子质量为10W一54。答案为A。
点拨:酯化反应中的定量关系,试题中常用来推断羧酸、醇或酯的分子式和结构。
四、从酯化反应实验突破有机实验
酯化反应实验是人教版《必修2》“生活中常见有机物”性质探究实验,也是一个典型的有机化合物制备实验。做好这个实验能很好地培养学生有机化学实验基础与探究能力、分析问题和解决化学问题的能力。
例4:“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室可以用下图所示的装置制取乙酸乙酯。回答下列问题:
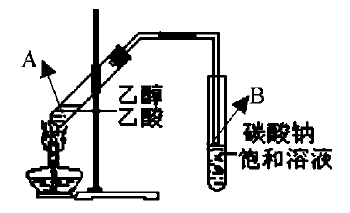
(1)写出制取乙酸乙酯的化学反应方程式
(2)该反应的平衡常数表达式K=
(3)在大试管A中配制一定比例的乙醇、乙酸和浓硫酸的混合液的方法是。然后轻轻振荡试管,使之混合均匀,还要再加入,理由
(4)试管A倾斜加热的目的是:
(5)A中加入浓硫酸的作用是:
(6)试管B中饱和碳酸钠溶液的主要作用是_ 。
(7)若要把制得的乙酸乙酯分离出来,应采用的实验操作是
(8)生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应的限度,也即达到化学平衡状态。下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有 _(填序号)。
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
④正反应的速率与逆反应的速率相等
⑤混合物中各物质的浓度不再变化
解析:酯化反应是乙酸和乙醇在浓硫酸催化下加热回流反应。反应速率慢,反应是可逆的且产率低。因为此反应是在非水体系中进行,所以生成的水应写入平衡常数表达式。此反应中应先加入过量无水乙醇,再加入浓硫酸,最后加入冰酯酸。为了防止暴沸,还要加入碎瓷片。为了利于乙酸乙酯的合成,先要小火加热,再大火加热。浓硫酸既可以加快反应速率,又可以除去反应的副产物水,提高酯的产率。
答案
(l)略
(2)
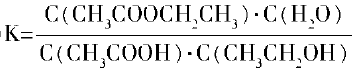
(3)先加入乙醇,再缓慢加入浓硫酸,边加边振荡试管,待冷却至室温时,最后加入乙酸并摇匀。
(4)增大受热面,加快反应速率。分离出产物,促使平衡正向移动。
(5)催化剂;吸水剂。
(6)除去乙酸和乙醇,降低乙酸乙酯的溶解度。
(7)冷却,分液。
(8)②④⑤。
点拨:酯化反应实验是高中化学中涉及考点最广最全的实验,既可以考查仪器的使用、装置的作用和气密性检验、实验安全、物质的分离提纯等知识,又可考查化学反应速率、化学平衡等相关理论知识。多角度深入挖掘此实验,能提高学生化学实验综合素质。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
要理解溴的四氯化碳溶液不能与饱和醛发生反应,核心在于反应...
酸酐(Acid Anhydride)是一类在无机化学与有机化学中均具有重要...
一、电子效应:官能团的“性格”密码 在比较酸性前,必须先理...
有机氰化物是指分子中含有氰基(-CN,氰基中 C 与 N 以三键连接...
有机化学中的还原反应是高考核心考点之一,其本质是有机分子...
【导读】环氧乙烷与HO的反应是亲核加成反应,其本质是环氧乙...